Феохромоцитома/параганглиома
Феохромоцитома — это опухоль мозгового слоя надпочечника, состоящая из хромаффинных клеток, продуцирующая катехоламины (адреналин, норадреналин и дофамин). Параганглиома – это опухоль, состоящая из вненадпочечниковой хромаффинной ткани симпатических паравертебральных ганглиев грудной клетки, брюшной полости и таза. Мозговой слой надпочечника является одним из крупных параганглиев, поэтому надпочечниковые феохромоцитомы являются частным случаем параганглиомы. Параганглиомы, также, могут развиваться в парасимпатических ганглиях шеи и основания черепа вдоль языкоглоточного и блуждающего нервов, они не продуцируют катехоламины. Примерно 80-85% опухолей хромаффинной ткани являются феохромоцитомой, в то время как 15-20% — параганглиомой [1].
Этиология и патогенез
Большинство ФХЦ/ПГ являются результатом спорадической мутации, однако в более, чем в 30% случаев опухоль возникает в результате герминальной мутации. По меньшей мере, у 40% детей с ФХЦ/ПГ выявляется генетическая причина болезни. В отличие от спорадической ФХЦ/ПГ, которая обычно является солитарной и односторонней, семейная (наследственная) ФХЦ/ПГ часто мультифокальная и двусторонняя.
Эпидемиология
Распространенность ФХЦ/ПГ среди пациентов с гипертензией составляет 0,2-0,6%. ФХЦ/ПГ может не диагностироваться при жизни. По данным аутопсии ФХЦ/ПГ выявляется у 0,05-0,1% пациентов. Примерно у 5% пациентов с инциденталомой надпочечника, обнаруженной во время анатомического вскрытия, диагностировали феохромоцитому. У детей с гипертензией распространенность ФХЦ/ПГ выше — около 1,7%. По меньшей мере, у трети пациентов с ФХЦ/ПГ причиной заболевания является наследственная мутация. У пациентов с наследственным синдромом, ассоциированным с ФХЦ/ПГ, фенотипическая пенетрантность опухоли составляет 50% случаев, которая отличается мультифокальным ростом и более ранним возрастом манифестации, чем у пациентов со спорадической феохромоцитомой (табл. 1) [2].
Известно, что ФХЦ/ПГ в большинстве случаев вырабатывает в больших количествах катехоламины и отсутствие лечения может привести к сердечно-сосудистым и церебральным катастрофам, вплоть до смертельного исхода. Со временем увеличивающаяся в размерах опухоль может вызвать компрессионный синдром. Выявление ФХЦ/ПГ в рамках наследственных синдромов может быть поводом для своевременной диагностики и лечения других членов семьи пробанда. Распространенность злокачественной феохромоцитомы составляет 10-17%. Злокачественность феохромоцитомы определяют не по обычным морфологическим и иммуногистохимическим критериям, а по наличию метастазов в нехромаффинной ткани. При мутациях в гене, кодирующем субъединицу В сукцинатдегидрогеназы (SDH-B), ФХЦ/ПГ имеет злокачественный характер более, чем в 40 % наблюдений [3].
Диагностика
Наиболее важным этапом диагностики ФХЦ/ПГ — своевременно распознать признаки, симптомы и другие проявления заболевания, которые могут указывать на необходимость лабораторного обследования. Заподозрить ФХЦ/ПГ можно при симптомах, проявляющихся после приема некоторых препаратов [4].

Таблица 1. Лекарства, способные вызвать эпизод повышения АД или тахиаритмии у пациентов с ФХЦ/ПГ.
*- при блокаде β2-адренорепторов, обладающих литическим действием при сокращении гладких мышц сосудов возникает пародоксальное повышение АД (феномен проявляется при адреналиновом типе опухолевой секреции).
Также, показаниями для диагностики феохромоцитомы являются: отягощенный семейный анамнез, наличие ФХЦ/ПГ у пациента в анамнезе, наличие любых компонентов наследственных синдромов ассоциированных с ФХЦ/ПГ (табл. 2).

Таблица 2. Клинические признаки синдромов, ассоциированных с ФХЦ/ПГ
-симптомы ФХЦ/ПГ, особенно пароксизмального типа (АГ, тахикардия, головная боль, профузная потливость);
-симптомы ФХЦ/ПГ, спровоцированные медикаментозно (антагонисты допамина, опиоиды, ингибиторы МАО, ингибиторы обратного захвата норадреналина и серотонина, кортикостероиды и т.д.) или при повышении давления в брюшной полости (пальпация, мочеиспускание, дефекация);
-наличие любых компонентов наследственных синдромов, ассоциированных с ФХЦ/ПГ.
- В качестве метода первичной диагностики ФХЦ/ПГ рекомендовано определение свободных метанефринов плазмы или фракционированных метанефринов суточной мочи.
Комментарий: Новые технические достижения и углубленное изучение метаболизма катехоламинов позволили доказать значительное преимущество исследования свободных метанефринов плазмы или фракционированных метанефринов мочи, по сравнению с другими тестами. Метанефрины вырабатываются хромаффинными клетками надпочечников или опухоли метилированием катехоламинов ферментом катехоламин-О-метилтрансферазой, который также является непосредственным продуктом синтеза катехоламинов [4,5].
Измерение катехоламинов мочи и ВМК компрометировало себя множеством ложноотрицательных результатов, тогда как анализ метанефринов мочи имел более точные результаты. В настоящее время, нет никаких доказательств о каком-либо преимуществе исследования разовой мочи в отличие стандартной суточной мочи. Для подтверждения полноты суточного сбора, необходимо определение креатинина мочи [6].
Lenders et al. впервые подтвердили преимущество исследования свободных метанефринов плазмы для диагностики ФХЦ/ПГ. Диагностическая специфичность была схожа с другими тестами, однако чувствительность значительно выше. При наследственной ФХЦ/ПГ также отмечена очень высокая чувствительность — 97%, в то время как при использовании старых тестов она составила лишь 47-74%. В итоговом отчете этого исследования, проведенного на 800 пациентах, установлено, что преимущество определения метанефринов плазмы неоспоримо, даже по сравнению с комбинацией нескольких «старых» тестов. Высокая точность метода исследования свободных метанефринов плазмы, в настоящее время, подтверждена 15 независимыми исследованиями [7].
В пяти из пятнадцати исследований были проведены сравнения определений свободных метанефринов плазмы и фракционированных метанефринов мочи. Результаты показали большую специфичность плазмы, чем мочи, однако все эти исследования имели разные ограничения и не сравнивались исключительно в рамках спектрометрических измерений [8].
- Для определения метилированных производных катехоламинов (метанефрина, норметанефрина и метокситирамина) в биологических жидкостях рекомендуется использовать метод жидкостной хроматография с масс-спектрометрией или электрохимический анализ.
Комментарий: Фракционированные метанефрины могут определяться при помощи жидкостной хроматографии электрохимическими, флуорометрическими детекторами (LC-ECD) или тандемными масс-спектрометрами (LC-MS/MS), а также, при помощи иммунологического метода.
При сравнении результатов исследований, восемь из которых проведены с помощью LC-ECD и семь посредством иммунологического метода, определено, что диагностическая чувствительность последнего является более низкой. В другом межлабораторном исследовании, также, показано, что иммунологический метод не только неточен, но и может значительно занижать плазменные концентрации метанефринов по сравнению с LC-ECD и LC-MS/MS. Таким образом, для диагностики ФХЦ/ПГ следует применять более точные и достоверные лабораторные методы [9].
- Забор крови для определения уровня метанефринов рекомендовано проводить в положении лежа после 30-минутного горизонтального положения с использованием соответствующих референсных интервалов.
Комментарий: Забор крови для определения метанефринов плазмы для диагностики ФХЦ/ПГ необходимо проводить в положении лежа на спине. Это обусловлено быстрым клиренсом метаболитов катехоламинов и выраженным влиянием активации симпатической нервной системы при вертикальном положении на стимуляцию выработки норадреналина. Lenders et al проанализировали результаты тестов проведенных у 60 пациентов с эссенциальной гипертензией в положении лежа (после 30 минут покоя) и сидя. Отмечено снижение норметанефрина в положении лежа. При проведении дальнейших исследований на 872 пациентах, подсчитано, что при проведении анализа крови в положении сидя, ложноположительных результатов в 2,8 раза больше, чем в положении лежа [10].
Забор крови в положении лежа отнимает больше времени и приводит к дополнительным затратам. До проведения забора крови пациенты должны находиться в положении лежа не менее 30 минут. В случаях, когда по какой-то причине выполнение этой рекомендации невозможно, альтернативным вариантом является исследование фракционированных метанефринов мочи [6].
- Всем пациентам с положительным результатом тестирования рекомендуется углубленное обследование для исключения или подтверждения ФХЦПГ.
Комментарий: Несмотря на высокую чувствительность лабораторной диагностики, специфичность методов определения фракционированных метанефринов заставляет желать лучшего; положительные результаты не всегда подразумевают наличие опухоли. Согласно ретроспективным анализам, проведенных Yu и Wei на 1896 пациентах, ложноположительные результаты составляют 19-21% [11].
Более, чем 75% всех ФХЦ/ПГ могут быть правильно диагностированы в зависимости от уровня повышения и характера секреции метанефринов. Например, совместное повышение норметанефрина и метанефрина редко является ложноположительным результатом, и определяется, по меньшей мере, в половине случаев у пациентов с феохромоцитомой надпочечника. Выявление трёхкратного повышения либо норметанефрина, либо метанефрина также обладает высокой специфичностью и не требует подтверждающих тестов [6].
Значимой проблемой интерпретации положительного результата теста являются невысокие показатели метанефринов, в которые попадают и четверть пациентов с ФХЦ/ПГ и, в гораздо большей степени, пациенты без опухоли, или с опухолью надпочечника иного происхождения. В большинстве случаев причиной ложноположительного результата является нарушение техники проведения исследования, что требует повторного определения. Если же при повторном тестировании вновь получен положительный результат с невысокими показателями метанефринов, одним из методов дифференциальной диагностики является подавляющий тест с клонидином с измерением норметанефрина плазмы. Клонидин – центральный α2-адреномиметик, который ингибирует высвобождение норадреналина из периферических нервных окончаний, но не влияет на автономную опухолевую секрецию катехоламинов. Предполагается высокая специфичность теста — 100%, чувствительность 97% — однако, эти данные не подтверждены в проспективных исследованиях [6].
Условием проведения теста с клонидином является отмена, не менее чем, за 48ч, симпатолитиков (в том числе адреноблокаторов). Тест выполняется при АД более 110/60 мм. рт. ст. и отсутствии постуральной гипотензии. Венозный забор крови на базальный норметанефрин плазмы выполняется в положении лежа на 20-ой минуте. Затем клонидин принимают внутрь в дозе 0,3 мг/70 кг массы тела, через 3 часа после приема препарата проводят повторный забор крови, пробирки немедленно помещают в лед. ФХЦ/ПГ наиболее вероятна при повышенном уровне норметанефрина плазмы через 3 часа после приема клонидина.
В некоторых случаях при получении «серой зоны» уровня метанефринов приемлема выжидательная тактика — повторное тестирование через 6 месяцев. Некоторые препараты, которые оказывают влияние на методы измерения (например, ацетаминофен, мезаламин, сульфасалазин в LC-ECD методе) или непосредственно на катехоламины (например, трициклические антидепрессанты), могут иногда значительно искажать результаты лабораторного теста (табл. 3) [12].
Таблица 3. Перечень препаратов, влияющих на показатели метанефринов плазмы и мочи (ложноположительный результат)
++ высокое увеличение; + умеренное увеличение; — без увеличения
Возможной причиной ложноположительного результата может быть физиологический стресс на фоне тяжелого заболевания и интенсивной терапии, и, просто, лабораторная ошибка. В таких случаях необходимо повторное тестирование после исключения всех возможных факторов влияния на показатели [6].
Некоторые специалисты предлагают исследование комбинации уровня хромогранина А крови и фракционированных метанефринов мочи [13].
При определении метаболита дофамина — 3-метокситирамина плазмы необходимо придерживаться специальной диеты. Забор крови должен быть сделан сразу после ночного сна [14].
Таким образом, всем пациентам с положительным результатом тестирования показано проведение дальнейшего диагностического обследования. Выбор дополнительного лабораторного исследования или переход на следующий уровень диагностики (визуализация) зависит от многосторонней клинической оценки [4].
- Топическая диагностика ФХЦ/ПГ рекомендована только при наличии лабораторных данных о диагностически значимом повышении метанефринов.
Комментарий: Рекомендация основана на высокой отрицательной прогностической ценности современных биохимических тестов. Во избежание финансовых затрат и ненужной лучевой нагрузки необходимо лабораторное подтверждение ФХЦ/ПГ до проведения визуализирующих исследований. Исключения могут составлять некорректно проводимое биохимическое тестирование, когда очень высокий уровень метаболитов катехоламинов определяется как нормальный в результате лабораторного «hook»-эффекта («оглушения»).
Однако, как известно, некоторые параганглиомы не проявляются повышением уровня метанефринов. Параганглиомы головы и шеи не имеют механизма биосинтеза катехоламинов и могут достигать больших размеров [15].
- В качестве метода выбора в топической диагностике ФХЦ органов грудной клетки, брюшной полости и малого таза рекомендована компьютерная томография (КТ), обладающая лучшим пространственным разрешением и цифровой информацией о плотности опухоли на всех фазах исследования при сравнении с МРТ.
Комментарий: КТ с контрастированием является превосходным визуализирующим методом для уточнения локализации ФХЦ/ПГ с чувствительностью 88-100%. По данным КТ ФХЦ/ПГ может быть гомогенной или гетерогенной, солидной или кистозной структуры, с участками некроза и с кальцинатами. 87-100% ФХЦ/ПГ имеют нативную плотность более 10 HU, процент «вымывания» (washout) может составлять более 60 через 15 минут [16].
В последние годы появился ряд исследований, в которых в качестве верифицирующего теста по отношению к «серой зоне» метанефринов предлагается оценка нативной плотности тканевого компонента опухоли надпочечника при КТ. При показателях менее 10 HU вероятность феохромоцитомы крайне мала, отрицательная прогностическая ценность низкой нативной плотности опухоли приближена к абсолютным значениям. На основании исследований ставится под сомнение необходимость исследования метанефринов у нормотензивных пациентов с низкой плотностью инциденталомы надпочечников. Полученные данные требуют дальнейших исследований [2].
ФХЦ/ПГ по данным МРТ отличается сигналом высокой интенсивности в T2-взвешенных изображениях, однако недавнее исследование показало, что в феохромоцитома по данным МРТ диагностируется достаточно редко.
Использование нейодного контрастирования относительно безопасно для пациента с ФХЦ/ПГ и может проводится без предварительной подготовки. Современные сканеры способны обнаруживать опухоли размерами от 5 мм и более. Так как большинство ФХЦ/ПГ локализуются в брюшной полости, в первую очередь должна быть проведена КТ брюшной полости. КТ предпочтительнее МРТ для поиска метастазирования в легкие [6].
- МРТ рекомендовано пациентам при параганглиомах головы и шеи, а также, при строгом индивидуальном ограничении лучевой нагрузки.
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 3).
Комментарий: По результатам некоторых исследований, чувствительность КТ при вненадпочечниковой, рецидивирующей, метастатической опухоли и остаточной ткани составляет 57%, что ниже, чем у МРТ. Для параганглиом головы и шеи чувствительность МРТ составляет 90-95% [15].
- Сцинтиграфия с 123 I- или 131 I- метайодбензилгуанидином (I-МЙБГ) рекомендована при подозрении на метастатическое поражение, вненадпочечниковую (за исключением ФХЦ/ПГ головы и шеи), или рецидивирующую ФХЦ/ПГ, при перспективе терапевтического использования 131 I-МЙБГ.
Комментарий: В редких случаях ФХЦ/ПГ может не выявляться методом анатомической визуализации вследствие нестандартной локализации, небольшого размера, наличия хирургических артефактов или послеоперационных изменений. Такие опухоли могут быть обнаружены только функциональными методами исследования.
Для выявления ФХЦ/ПГ предпочтительнее использовать сцинтиграфию с 123 I-МЙБГ по сравнению с 131 I-МЙБГ. Необходимо иметь в виду, что в 50% случаев отмечается физиологическое накопление изотопа в здоровых надпочечниках, которое, также, может быть ассиметричным [17].
Для феохромоцитомы чувствительность сцинтиграфии с 123 I-МЙБГ составляет 85 — 88% и 56 — 75% для параганглиомы, в то время как специфичность 70-100% и 84-100% соответственно. Чувствительность метода для выявления метастатической ФХЦ/ПГ в пределах 56-83%,а для рецидивирующей примерно 75%. Результаты мета-анализа показали, что чувствительность и специфичность для ФХЦ равны 90%, тогда как чувствительность относительно параганглиомы составила 98%,а злокачественной ФХЦ/ПГ — 79% . Согласно результатам другого мета-анализа (15 исследований) ФХЦ/ПГ, чувствительность метода составила 94%, а специфичность — 92%. Для ФХЦ/ПГ, связанной с дефектом фермента SDH (в особенности субъединицы B), чувствительность сцинтиграфии с 123 I-МЙБГ составляет менее 50%. Подобные значения чувствительности указаны относительно параганглиомы головы и шеи, грудной клетки, мочевого пузыря и для рецидивирующей ФХЦ/ПГ[18].
Недавние исследования предположили, что эффективность сцинтиграфии с 123 I-МЙБГ/ОФЭКТ схожа с ПЭТ- 18 F-фтордофамином, ПЭТ- 18 F-фтордигидроксифенилаланином и 18 F-ФДГ для поиска ФХЦ/ПГ. Для параганглиомы или злокачественной феохромоцитомы, сцинтиграфия 123 I-МЙБГ менее предпочтительна ПЭТ с 18 F-ФДГ, 18 F-ФДОФА и сканирование рецептора соматостатина с 111 In- пентетриотидом [15].
Для пациентов с метастазами ФХЦ/ПГ, имеющих противопоказания к оперативному лечению, результат сцинтиграфии с 123 I-МЙБГ важен для принятия решения о возможности лечения 131 I-МЙБГ.
Некоторые медицинские препараты могут снижать накопление 123 I-МЙБГ: 1) симпатомиметики 2) вещества, блокирующие транспорт катехоламинов (например, кокаин и трициклические антидепрессанты) 3) блокаторы кальциевых каналов и некоторые α- и β — адреноблокаторы (например, лабеталол). Таким образом, необходимо отменить вышеперечисленные лекарственные средства примерно за 2 недели до исследования. Накопление 123 I-МЙБГ значительно снижено в некротизированных опухолях. Применение сцинтиграфии с 123 I-МЙБГ у беременных противопоказано (6).
- При метастатической ФХЦПГ рекомендована позитронно-эмиссионная томография с 18 F-фтордезоксиглюкозой в сочетании с КТ (ПЭТКТ- 18 F-ФДГ), которая обладает большей чувствительностью по сравнению со сцинтиграфией с 123 I-МЙБГ.
Комментарий: В пилотном исследовании Shulkin et al. [19] общая чувствительность ПЭТ с 18 F-ФДГ составила 76%, но она была выше у пациентов со злокачественной опухолью (88%), по сравнению с пациентами с доброкачественной (58%) ФХЦ/ПГ. Дальнейшие исследования, также, показали превосходство ПЭТ с 18 F-ФДГ по сравнению со сцинтиграфией с 123 I-МЙБГ для обнаружения метастатической ФХЦ/ПГ. Общая чувствительность ПЭТ с 18 F-ФДГ составляла 74-100%, с преимуществом для злокачественной ФХЦ/ПГ, особенно при мутации SDHB [20].
Применение ПЭТ для беременных женщин противопоказано. Кроме того, есть данные, что некоторые препараты могут значительно уменьшить накопление радиоактивных веществ, применяемых для проведения ПЭТ, но информация крайне ограничена и необходимы дальнейшие исследования.
- Для всех пациентов с ФХЦ/ПГ рекомендовано рассмотрение вопроса о проведении генетического обследования. Генетический поиск должен основываться на конкретных фенотипических признаках заболевания и данных семейного анамнеза.
Комментарий: С 1990 года были открыты 14 генов, ассоциированных с ФХЦ/ПГ: NF1, RET, VHL, SDHD, SDHC, SDHB, EGLN1/PHD2, KIF1 β, SDH5/SDHAF2, IDH1, TMEM127, SDHA, MAX и HIF2α. Роль мутации EGLN1/PHD2, KIF1β и IDH1, как основная причина наследственной ФХЦ/ПГ, не была подтверждена в других исследованиях. Мутация в HIF2α, отмеченная у некоторых пациентов, также, требует подтверждения [6].
Существует несколько причин необходимости генетического тестирования у всех пациентов с ФХЦ/ПГ: 1) более трети всех пациентов с ФХЦ/ПГ имеют наследственные мутации; 2) у более, чем 40% пациентов с мутацией SDHB выявляется злокачественная ФХЦ/ПГ; 3) диагностирование наследственного синдрома у пробанда залог своевременной диагностики и лечения других членов семьи; 4) возможность использования предимплантационной и пренатальной диагностики [2].
Пациенты с ФХЦ/ПГ могут иметь особенности, указывающие на высокую вероятность наследственного заболевания: отягощенный семейный анамнез, другие синдромальные проявления, мультифокальная, двусторонняя, рецидивирующая, вненадпочечниковая и злокачественная ФХЦ/ПГ [2].
После сообщения Neumann et al. [21], типирование основных генов, ассоциированных с ФХЦ/ПГ (SDHB, SDHD, VHL, RET), проведено еще в восьми исследованиях, в общей сложности у 3694 пациентов с 1250 наследственными мутациями (33,8%). Самая распространенная мутация в гене SDHB (10,3%), далее SDHD (8,9%), VHL (7,3%), RET (6,3%) и NF1 (3,3%). Наследственные мутации SDHC, SDHA, MAX и TMEM127 выявлялись с частотой менее 2%. При обследовании 315 пациентов с очевидно спорадической ФХЦ/ПГ не было выявлено ни одного случая мутации SDHAF2 [22].
Примечательно, что в обзоре литературы, который включал только очевидно «спорадических» пациентов, распространенность мутации составила 11,6% [23].
Таким образом, необходимость генетического исследования должна быть оценена для каждого пациента с ФХЦ/ПГ. Учитывая высокую стоимость, тотальный скрининг всех точек возможных мутаций нецелесообразен, исследование должно выполняться по определенному алгоритму, основанному на клинических, топических, лабораторных и анамнестических данных конкретного больного [2].
Минимум шесть различных синдромов, наследуемых по аутосомно-доминантному типу, имеют четкие клинические признаки: нейрофиброматоз I типа, МЭН 2 типа, Болезнь фон Гиппеля-Линдау (см. Таблицу 2), SDHB-параганглиомы (рак почек), триада Карни (параганглиомы, эпителиоидная лейомиосаркома желудка, хондромы легких) и синдром Карни – Стратакиса (параганглиомы и стромальная карцинома желудка). Нет необходимости в определении мутации NF1, так как диагноз может быть поставлен на основании наличия минимум двух признаков синдрома. Тем не менее, есть сообщения, что у некоторых пациентов с нейрофиброматозом 1 типа отмечается мягкое течение заболевания, когда можно предположить спорадическую ФХЦ/ПГ. Таким образом, необходим тщательный клинический поиск у всех пациентов с ФХЦ/ПГ для предположения наличия определенной мутации [2].
В обзоре Pasini и Stratakis [24] сообщено, что распространенность мутации гена SDHB зарегистрирована у 36% пациентов со злокачественной ФХЦ/ПГ. Кроме того, более высокий риск наблюдался в педиатрической практике. Тем не менее, мета-анализ 12 исследований показал, что заболеваемость и распространенность злокачественного варианта ФХЦ/ПГ у пациентов с мутацией гена SDHB составили 17% и 13%, соответственно [6]. Таким образом, проведение генетического тестирования на мутацию гена SDHB обязательно для пациентов с метастазами ФХЦ/ПГ.
Доказано, что пациенты с наследственными мутациями заболевают в более молодом возрасте, чем пациенты со спорадической ФХЦ/ПГ[2]. Вероятность мутации у пациентов с ФХЦ/ПГ, среди больных моложе 45 лет, в 5 раз выше. Распространенность наследственных мутаций среди детей с ФХЦ/ПГ особенно высока [25], скрининг в подобных случаях наиболее актуален.
Неоднократно подтверждена высокая распространенность наследственных мутаций среди пациентов с двусторонней и мультифокальной ФХЦ/ПГ. Мутации в гене SDHB ассоциируются, главным образом, с вненадпочечниковой локализацией опухоли [6].
В работе Pasini и Stratakis [24] подробно изучены генотип–фенотипические корреляции, связанные с мутацией гена SDHx. Множественные опухоли головы и шеи, наличие отягощенного семейного анамнеза по отцовской линии, указывают на мутацию гена SDHD. При мутации гена SDHB чаще диагностируется солитарная вненадпочечниковая опухоль при неотягощенном семейном анамнезе. Редкие мутации гена SDHC отличаются почти 100-процентой пенетрантностью клинических признаков заболевания. Мутации генов SDHA и SDHAF2 были описаны только у нескольких пациентов. Отрицательный результат определения мутации гена SDHB в опухолевых тканях предполагает наличие мутации в одном из других SDHx генах. Гормонально-активные ФХЦ/ПГ, связанные с мутацией гена SDHx, лабораторно проявляются преимущественным повышением метокситирамина, реже — норметанефрина [26].
Наследственные ФХЦ/ПГ, вследствие мутаций генов TMEM127 или MAX, встречаются у пациентов с отягощенным семейным анамнезом, диагностируются в зрелом возрасте, с локализацией опухоли в надпочечниках. Обычно ФХЦ/ПГ, ассоциированные с мутацией TMEM127, синтезируют адреналин, в то время как пациенты с мутацией MAX имеют смешанный тип секреции [27].
- Пациентам с вненадпочечниковой параганглиомой первично рекомендовано исключать весь спектр SDH-х мутаций, при метастатическом поражении — мутацию SDHB.
- Рекомендуется разъяснять пациентам смысл и результат генетического тестирования до и после его проведения (неклассифицированная рекомендация).
Комментарий: Все молекулярно — генетические исследования должны быть проведены в аккредитованных лабораториях в целях обеспечения гарантии качества. Предварительно должно быть получено подписанное информированное согласие пациента на исследование. Пациент должен быть проконсультирован до и после проведения тестирования и проинформирован о подозреваемых наследственных синдромах, их диагностики и лечении, о диагностических результатах соответствующего генетического тестирования и риске передать заболевание своим детям.
Неверная оценка генетического тестирования или неправильные результаты могут привести к опасным последствиям для пациента и его семьи. Каждый результат должен интерпретироваться с осторожностью. Результат генетического тестирования при ФХЦ/ПГ может быть положительным (когда четко определена мутация), отрицательным (когда не обнаружено ни мутации, ни полиморфизма в последовательности ДНК) или неопределенным, когда обнаружен т.н. вариант неизвестного значения (VUS) [28]. Оценка каждого результата должна быть проведена с учетом клинической ситуации и индивидуального подхода к пациенту.
Лечение
- Всем пациентам с подозрением на ФХЦ/ПГ рекомендована предоперационная подготовка α-адреноблокаторами. Исключением являются пациенты с гормонально-неактивными опухолями головы и шеи.
Комментарий: Несмотря на то, что рандомизированные контролируемые клинические исследования для сравнительной оценки эффективности неселективных и селективных α- адреноблокаторов еще не проводились, имеются ретроспективные данные, поддерживающие применение в первую очередь α-адреноблокаторов для снижения риска периоперационных осложнений. Исследования подтвердили, что применение α1-адреноблокаторов связано с более низкими предоперационным диастолическим АД и интраоперационной ЧСС, лучшим исходом послеоперационного периода и меньшим количеством побочных эффектов, таких как реактивная тахикардия и плохоуправляемая постоянная послеоперационная гипотония. Однако, имеются исследования, которые не показали различий в применении селективных и неселективных α-адреноблокаторов.
Блокаторы кальциевых каналов чаще всего применяются в качестве дополнительного препарата для дальнейшего улучшения контроля артериального давления у пациентов, которым уже были назначены α –адреноблокаторы (Таблица 5). Некоторые специалисты предполагают их использовать как препарат первой линии.
β-адреноблокаторы назначаются предоперационно при тахикардии и только после предварительного применения α-адреноблокаторов. Применение β -адреноблокаторов без предварительного использования α -адреноблокаторов может привести к состоянию неуправляемой гемодинамики. Не существует обоснованных доказательств о предпочтительном применении селективных β-адреноблокаторов над неселективными.
Не рекомендуется применение лабеталола в качестве первоначальной терапии вследствие более мощного β- эффекта (α:β в соотношении 1:5).
На небольшой период времени перед операцией могут применяться блокаторы синтеза катехоламинов, в том числе в комбинации с α -адреноблокаторами [6].
Некоторые специалисты считают, что пациентам с нормальным артериальным давлением могут не назначаться α1-адреноблокаторы [29]. Тем не менее, таким пациентам настоятельно рекомендуется назначение α-адреноблокаторов для предотвращения непредсказуемого подъема артериального давления во ходе операции.

- Рекомендуется предоперационная подготовка α-адреноблокаторами и, по показаниям, β-адреноблокаторами до достижения критериев ее эффективности, которые включают: нормализацию уровня артериального давления, достижение целевой частоты сердечных сокращений, ликвидацию, индуцированного избытком катехоламинов, гиповолемического синдрома.
Комментарий: Рандомизированных контролируемых исследований, доказывающих необходимость определенного периода предоперационного лечения, в настоящее время, нет. Однако, по данным ретроспективных исследований α-адреноблокаторы должны быть назначены минимум за 7 дней до операции. Также, некоторыми специалистами отмечена эффективность внутривенного введения в течение 5 часов альфа-адреноблокатора на протяжении 3 дней перед операцией [30].
Отсутствуют доказательства о необходимости назначения диеты с высоким содержанием натрия и приема повышенного количества жидкости. Однако, согласно ретроспективным данным, включение в рацион диеты с высоким содержанием натрия через несколько дней после начала приема α-адреноблокаторов, предотвращает снижение объема циркулирующей крови, развитие ортостатической гипотензии перед операцией и снижает риск значительной артериальной гипотензии после удаления опухоли. Внутривенное введение физиологического раствора (1-2 литра), также эффективно, особенно вечером накануне операции. Доказано, что применение только α-адреноблокаторов предотвращает потерю объема крови у 60% пациентов. Необходимо с осторожностью назначать водную нагрузку пациентам с сердечной и почечной недостаточностью. Контроль за гиповолемическим синдромом осуществляют посредством измерения центрального венозного давления, ультразвуковой оценки размера нижней полой вены и величиной ее уменьшения на вдохе, а также по клиническим признакам (ортостатическая проба).
Согласно ретроспективным исследованиям, оптимальный уровень артериального давления должен составлять менее 130/80 мм рт. ст. в положении сидя и более, чем 90 мм рт. ст. для систолического артериального давления в положении стоя, при частоте пульса в 60-70 ударов в минуту сидя для взрослых пациентов. Определение целевых гемодинамических значений необходимо проводить в соответствии с возрастом и наличием сердечно-сосудистых заболеваний у пациента [6].
Особое внимание в послеоперационном периоде необходимо уделять контролю гликемии, и оценке развития надпочечниковой недостаточности у пациентов, которым проведены: 1) двусторонняя адреналэктомия; 2) двусторонняя резекция надпочечников; 3) односторонняя резекция единственного оставшегося надпочечника; 4) при большом объеме кровопотери.
- Пациентам с надпочечниковой феохромоцитомой рекомендуется проводить лапароскопическую адреналэктомию. Для больших (более 8 см) и инвазивных опухолей предпочтителен открытый доступ во избежание повреждения капсулы опухоли и ее диссеминирования. Эндоскопическое удаление вненадпочечниковых ФХЦ/ПГ рекомендуется только в специализированных ведущих хирургических центрах, исключительно для неинвазивных параганглиом малого размера.
Комментарий: Проспективные рандомизированные исследования относительно сравнения лапароскопической и открытой адреналэктомии при лечении феохромоцитомы не проводились. Однако, большое количество крупных учреждений продемонстрировали, что лапароскопическая адреналэктомия ассоциируется со снижением числа послеоперационных осложнений и порога болевого синдрома, меньшей кровопотерей и сокращением количества койко-дней [31]. Данных относительно каких-либо различий в частоте рецидива после открытой и лапароскопической адреналэктомии, в настоящее время, нет. Смертность составляет приблизительно 1%, частота необходимости инверсии, расширения объёма операции и обширных гемотрансфузий – около 5%.
Наиболее распространенные лапароскопические доступы — боковой трансабдоминальный (Gagner) и задний ретроперитонеальный (Walz). Первый доступ позволяет адекватно оценить состояние брюшной полости и имеет больше возможностей для иссечения опухолей больших размеров. Задний ретроперитонеальный доступ предпочтителен для пациентов, которые оперируются повторно на органах брюшной полости или для проведения двусторонней адреналэктомии при небольших опухолях. Параганглиомы чаще бывают злокачественными и локализуются в труднодоступных местах для лапароскопического доступа. Таким образом, при параганглиоме эндоскопическая операция требует большего опыта хирурга, в большинстве случаев предпочтительна открытая операция [32].
При разрыве капсулы опухоли, диссеминированные участки образования могут имплантироваться в брюшной полости и стать причиной рецидива. В связи с этим, для проведения эндоскопического доступа должны существовать разумные ограничения по размеру опухоли с учетом сохранения ее целостности при эвакуации из брюшной полости. В рекомендациях ENDO-2014 по ФХЦ/ПГ [6] предложено 6 см считать «порогом» для эндоскопических вмешательств. В этом случае около 50% пациентов должны оперироваться открытым способом, тем не менее, известно, что в настоящий момент около 90% вмешательств в специализированных клиниках выполняются эндоскопически. 8 см — размер опухоли, при котором отказ от эндоскопического вмешательства в большей степени соответствует принятой на современном этапе хирургической тактике. Более целесообразно в каждом конкретном случае оценивать перспективу эндоскопического доступа исходя из тщательного анализа топических данных и критичной самооценки хирургического опыта в отношении ФХЦ/ПГ.
- С целью предотвращения хронической надпочечниковой недостаточности при наследственной двусторонней ФХЦПГ возможно проведение с одной из сторон частичной адреналэктомии (предпочтительнее слева). Пациенту должны быть разъяснены негативные аспекты этой тактики (высокая вероятность местного рецидива и повторной операции в условиях рубцового процесса).
Комментарий: Резекция надпочечника с сохранением части коры в сравнении с адреналэктомией связана с определенным риском кровотечения. Использование гармонического скальпеля снижает риск кровотечения из рассеченного надпочечника. Успешная частичная адреналэктомия, у пациентов с предшествующей контралатеральной адреналэктомией, в 90% случаев не влечет за собой развитие послеоперационной надпочечниковой недостаточности и назначения пожизненной заместительной терапии. Однако, частичная адреналэктомия увеличивает риск рецидива опухоли из остаточной ткани мозгового слоя надпочечника. У пациентов с VHL в 10-15% случаях за 10 лет фиксируется рецидив опухоли. Совокупность частоты рецидива для пациентов с МЭН 2 типа после резекции за 5 и 10 лет составила 38,5% [33]. Риск хирургических осложнений при резекции рецидивирующей опухоли в ранее оперированной области выше, чем при первичных операциях.
Развития надпочечниковой недостаточности встречается реже при резекции небольших опухолей, расположенных ближе к периферии надпочечника и относительно далеко от надпочечниковой вены. В большинстве случаев, при неповрежденной центральной вене 1/3 одного надпочечника достаточно, чтобы сохранить функцию коры.
- Для постановки диагноза злокачественной ФХЦ/ПГ необходимо наличие метастатического поражения паренхиматозных органов или костей.
Комментарий: Вопрос о том, какие феохромоцитомы считать злокачественными, а какие доброкачественными — является причиной неутихающей дискуссии. Почвой для такой дискуссии является то, что при феохромоцитоме выявляется несоответствие доброкачественного, с морфологической точки зрения, характера первичной опухоли и последующего метастатического поражения. При выявленном метастатическом поражении доброкачественный характер первичной опухоли констатируется примерно в половине наблюдений.
С другой стороны, при использовании критериев ядерного и клеточного полиморфизма, атипии, наличия сосудистой и капсулярной инвазии — частота злокачественного поражения составляет 35-65%, однако клинически агрессивное течение практически не встречается. Капсулярная и сосудистая инвазия, клеточная атипия, сходство с детской нейробластомой – ни один из перечисленных гистологических признаков, рассмотренный отдельно, не способен определить метастатический потенциал опухоли. Если использовать иные (клинические) критерии злокачественности – инфильтративное распространение опухолевой ткани на окружающие органы и ткани, верифицированные метастазы — то частота злокачественного процесса составляет 3-10%. В настоящее время метастазами феохромоцитомы считают поражение костей и паренхиматозных органов. Отдельно рассматривается возможное злокачественное течение заболевания при мутации SDHB и преимущественном допаминовом типе секреции. Иные варианты распространения опухолевых масс в пределах брюшной и грудной полости необходимо интерпретировать, как первично-множественное поражение в рамках генетически-детерминированных феохромоцитом.
- При злокачественной ФХЦ/ПГ симптомы гормональной гиперпродукции рекомендуется купировать блокаторами адренергических рецепторов или ингибиторами тирозинкиназы (α-метилпаратирозином).
Комментарий: Симптомы катехоламиновой секреции могут быть купированы адренергическими блокаторами или α-метилпаратирозином. Очевидно, что эти средства не оказывают влияния на рост опухоли и метастазирование. Алгоритм ведения пациентов в целом не отличается от алгоритма предоперационной подготовки больных, однако предпочтение отдается титрованным по клиническому эффекту минимальным дозам блокаторов адренергических рецепторов. При применении α-метилпаратирозина происходит снижение общего количества катехоламинов за счет блокады их синтеза, и осложняется у части пациентов депрессивным состоянием. Несмотря на высокую эффективность, индивидуальное негативное психотропное влияние препарата ограничивает его применение.
- Для воздействия на опухолевый рост при злокачественной ФХЦ/ПГ рекомендуется рассмотреть возможность хирургического лечения, радиотаргетной терапии, при костных метастазах – дистанционной лучевой терапии.
Комментарий: В течение 5 лет после операции по поводу феохромоцитомы выживают обычно более 95% больных, а частота рецидивов не достигает 10%.
Стандартная химиотерапия дает неутешительные результаты. Большинство режимов использует препараты для лечения нейробластомы.
Дистанционная лучевая терапия (ДЛТ) опухолей из хромаффинных клеток до последнего времени считалась неэффективной, исключение составляют костные метастазы.
Все более многочисленными становятся сообщения об успешном лечении метастазов феохромоцитомы с помощью 131I-МЙБГ. Количество наблюдений с регрессированием размеров опухоли и увеличением продолжительности жизни достигает до 2/3 пролеченных больных.
Экспрессия соматостатиновых рецепторов в хромаффинных опухолях — уникальная возможность целевого назначения радионуклидов, связанных с аналогами соматостатина. При ФХЦ/ПГ экспрессия соматостатиновых рецепторов отмечена в 80% наблюдений. Многообещающими являются сообщения о возможности применения при распространенных злокачественных формах феохромоцитомы радиотаргетной терапии с радиоизотопами 177Lu-DOTA-octreotate и 90Y-DOTA-octreotate (полный и частичный ответ достигается до 35% наблюдений, стабилизация опухолевого роста до 75%).
Таким образом, злокачественные феохромоцитомы трудно поддаются терапии, однако на этом пути достигнуты определенные результаты. Возможно, что уникальные генетические характеристики феохромоцитомы будут, в конечном счете, использоваться в лечении агрессивных форм этой болезни.
- Пациентам с наследственной ФХЦ/ПГ рекомендован персонализированный подход к обследованию и лечению в соответствии фенотип-генотипическими особенностями заболевания (В1).
Комментарий: Известно, что характеристика (клинические признаки, тип секреции, локализация опухоли и др.) наследственной ФХЦ/ПГ зависит от типа мутации. Мутация генов RET и NF1 почти всегда ассоциируются с опухолями надпочечников, которые продуцируют преимущественно адреналин (и, соответственно, метанефрин). При опухолях вследствие мутации генов VHL и SDHx отмечается преимущественная секреция норадреналина и его метилированного производного – норметанефрина. У пациентов с мутацией гена SDHВ в 70% случаев отмечается выраженная секреция метокситирамина — метаболита дофамина. VHL-опухоли локализуются преимущественно в надпочечниках, но в 6-15% случаев возможна, сочетанная с надпочечниковой, вненадпочечниковая локализация. При мутации гена SDHx характерна, главным образом, вненадпочечниковая локализация, а также параганглиомы головы и шеи, в зависимости от мутации конкретной субъединицы SDH, чаще А и С. Пациенты с мутацией гена SDHB имеют большие вненадпочечниковые опухоли с высоким риском малигнизации. У пациентов с мутаций в гене RET и NF1 или у пациентов с преимущественной секрецией метанефринов, поиск феохромоцитомы должен начинаться с надпочечников. Описание вненадпочечниковой локализации или метастатического процесса при мутации RET — казуистика, как правило, связанная с диагностическими ошибками вследствие рецидива после первичной операции с произвольно или непроизвольно сохраненной резидуальной тканью надпочечника. У пациентов с мутациями генов SDHx – необходимо в первую очередь исключать вненадпочечниковую локализацию опухоли.
Таким образом, генетический скрининг, выбор метода функциональной визуализации и прочее, должны проводиться персонализировано, с учетом мутации и связанной с ней характеристикой ФХЦ/ПГ [15] (Схема 2, см. Приложение Б «Алгоритмы ведения пациентов»).
Визуализирующий метод выявления ФХЦ/ПГ специфичен для каждого генотипа. ПЭТ с применением 18F-ФДОФА чувствительнее, чем КТ, MРТ или любой другой метод функциональной диагностики для обнаружения параганглиом головы и шеи. ПЭТ с 18F-ФДГ — самый чувствительный метод в определении локализации любой ФХЦ/ПГ, кроме параганглиомы головы и шеи. Сцинтиграфия с 111In-пентетриотидом (Октреоскан) является хорошим визуализирующим методом для обнаружения ФХЦ/ПГ, ассоциированной с мутацией SDHx [15].
Всем пациентам с известной мутацией, ассоциированной с ФХЦ/ПГ, нужно проводить ежегодный лабораторный скрининг. Необходимо учитывать вероятность фенотипического проявления мутации и ее клинической агрессивности. Например, вследствие низкой пенетрантности ФХЦ/ПГ при NF1, скрининг должен проводиться только при наличии клинических признаков заболевания. С другой стороны, высокая смертность у пациентов с мутацией SDHB, связанная с высоким злокачественным потенциалом, поздней клинической манифестацией, обусловленной поздней гиперсекрецией катехоламинов, требует более тщательного обследования — периодическое проведение МРТ (чтобы избежать лишней лучевой нагрузки, КТ и функциональные методы топической диагностики должны применяться по строгим показаниям).
- Пациентам с ФХЦ/ПГ рекомендуется обследование и лечение в специализированных центрах экспертного уровня. (В2)
Комментарий: Согласно данным проведенных исследований, определено, что специализированные медучреждения отличаются более низкой послеоперационной смертностью, меньшим количеством койко-дней, финансовых затрат при лечении пациентов с ФХЦ/ПГ и периоперационных осложнений, чем неспециализированные медицинские центры [6].
Клинические проявления ФХЦ/ПГ очень разнообразны и могут являться частью синдромов с полиорганным поражением. Поэтому большинство врачей различных специальностей (кардиологи, анестезиологи, врачи отделения реанимации, акушер-гинекологи и прочие) не имеют достаточного опыта работы с такими пациентами.
Феохромоцитома — симптомы и лечение
Что такое феохромоцитома? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лукьянова Сергея Анатольевича, онколога со стажем в 19 лет.
Над статьей доктора Лукьянова Сергея Анатольевича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Феохромоцитома — это злокачественная гормонально-активная опухоль, которая выделяет катехоламины: адреналин и в меньших количествах норадреналин. В 90 % случаев она образуется в мозговом веществе надпочечников. Основные симптомы заболевания: рост артериального давления, головная боль и повышенная потливость.
Ранее феохромоцитомы относили как к доброкачественным, так и к злокачественным опухолям, но по последней классификации (ВОЗ, 2017), они все считаются злокачественными [37] .
Что такое надпочечники
Надпочечники — это парные эндокринные железы, расположенные над верхней частью почек. Каждый из них состоит из двух слоёв: коркового и мозгового. В корковом слое образуются кортикостероиды, среди которых — эстрогены и андрогены. В мозговом слое вырабатываются катехоламины: норадреналин, адреналин и дофамин [33] .
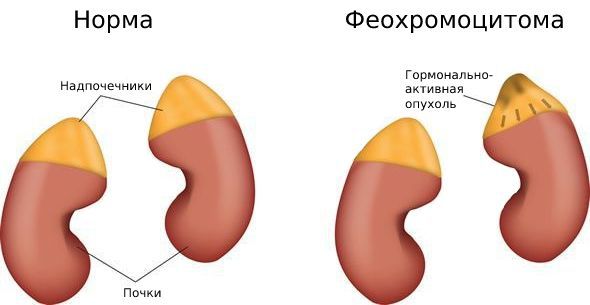
Распространённость
Ежегодная заболеваемость феохромоцитомами составляет 0,4–9,5 случаев на 1 миллион населения [29] . Они могут возникнуть в любом возрасте, но чаще всего выявляются в 20–50 лет. Среди мужчин и женщин феохромоцитомы встречаются примерно с одинаковой частотой.
До 60 % опухолей обнаруживаются случайно при ультразвуковом исследовании (УЗИ) и мультиспиральной компьютерной томографии (МСКТ) брюшной полости.
Причины феохромоцитомы
Единственная известная причина феохромоцитомы — наследственная предрасположенность [34] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы феохромоцитомы
Большинство симптомов вызвано избыточным производством катехоламинов с последующим их высвобождением в кровоток.
Клинические проявления
Основной симптом феохромоцитомы — артериальная гипертензия.
Другие признаки феохромоцитомы:
Катехоламиновые кризы
Катехоламиновый криз — это патологическое состояние, вызванное выбросом катехоламинов. При этом повышается артериальное давление, возникает головная боль и сердцебиения, усиливается потоотделение.
Катехоломиновый криз — наиболее опасное проявление феохромоцитомы, которое часто становится причиной тяжёлых осложнений: отёка лёгких, инфаркта миокарда, инсульта и смерти пациента. Чтобы предотвратить эти последствия требуется немедленное лечение [36] .
Спровоцировать криз могут различные факторы – физические нагрузки, психоэмоциональные переживания, переохлаждения и т. д.
Феохромоцитома у беременных
Феохромоцитома при беременности встречается крайне редко. У 87 % пациенток она сопровождается значительным повышением артериального давления. Однако оно может расти и при гестационной гипертонии, преэклампсии и эклампсии, поэтому отличить гормонально-активную опухоль от этих заболеваний по клиническим симптомам очень сложно [7] [8] [11] .
Феохромоцитому можно заподозрить при сочетании артериальной гипертензии с головной болью, сердцебиением, потливостью, повышенным уровнем глюкозы в крови и кардиомиопатией, а также при наличии следующих заболеваний и симптомов:
- медуллярный рак щитовидной железы;
- первичный гиперпаратиреоз (при деформации скелета);
- ганглионейроматоз;
- гемангиомы ЦНС и сетчатки;
- кисты и нейроэндокринные опухоли поджелудочной железы;
- опухоль эндолимфатического мешочка среднего уха;
- папиллярная цистаденома придатка яичка и широкой связки матки;
- гиперпигментация подмышечной и/или паховой области;
- пигментные пятна цвета «кофе с молоком»;
- гамартомы радужной оболочки глаза (узелки Лиша) [8][9] .
Патогенез феохромоцитомы
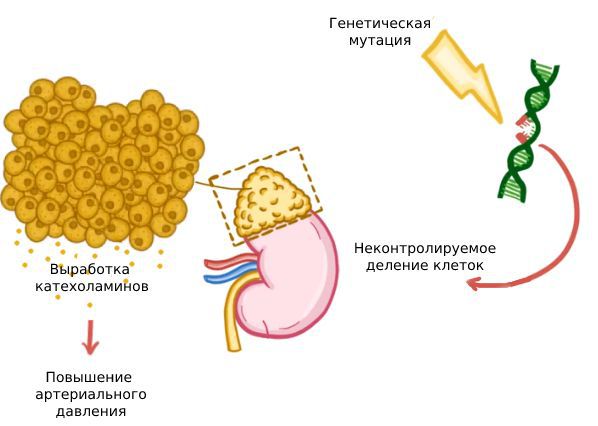
У пациентов с опухолями часто выявляется генетическая предрасположенность к их развитию. Появление феохромоцитом связано со следующими генам: протоонкогеном RET, генами супрессоров опухоли фон Гиппеля — Линдау (VHL), нейрофиброматоза типа 1 (NF1), TMEM127 и MAX, а также генами, кодирующими комплексные субъединицы сукцинатдегидрогеназы (SDHА, SDHB, SDHC и SDHD) и фактора её сборки (SDHAF1 и SDHAF2) [32] . Мутации в генах семейства SDH — наиболее распространённая причина наследственной формы заболевания.
Основные патофизиологические изменения в организме при феохромоцитоме связаны с высоким уровнем катехоломинов в крови. Они вырабатываются клетками опухоли, а некроз её ткани, изменение кровотока и другие причины приводят к их выбросу.
Взаимосвязь феохромоцитомы с другими опухолями
Обнаружена взаимосвязь феохромоцитомы с аденомой гипофиза, почечно-клеточным раком и опухолью желудочно-кишечного тракта. Эти открытия позволят с помощью молекулярно-генетического типирования выявить предрасположенность и предупредить развитие в будущем других опухолей. Такой подход называется персонализированной медициной.
Классификация и стадии развития феохромоцитомы
По локализации:
- Надпочечниковые (90 % случаев):
- двусторонние;
- односторонние.
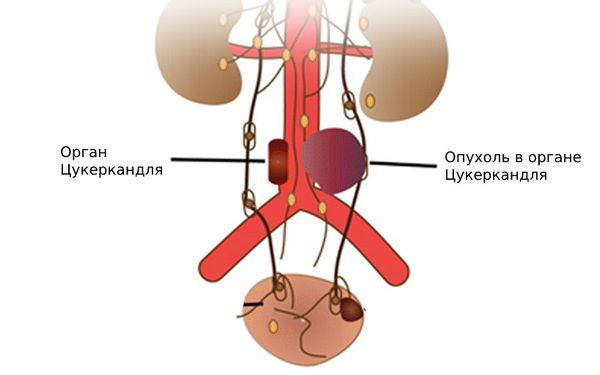
- Вненадпочечниковые:
- в околопозвонковых симпатических ганглиях — скоплениях нервных клеток, которые проходят по обе стороны спинного мозга ;
- в брюшной полости — 53 % вненадпочечниковых феохромоцитом выявляются в органе Цукеркандля, расположенном на брюшной аорте у начала нижней брыжеечной артерии [31] ;
- в области шеи .
По клиническому течению:
- Бессимптомная:
- «немая» форма — артериальное давление и уровень катехоламинов в норме;
- «скрытая» форма — повышенный уровень катехоламинов и нормальное артериальное давление.
- Клинически выраженная форма:
- пароксизмальная — артериальная гипертензия с кризами, возникает примерно у половины взрослых пациентов;
- персистирующая — постоянная артериальная гипертензия, встречается у 50 % взрослых и у 60 – 90 % детей [30] ;
- смешанная.
- Атипичная форма:
- с пониженным артериальным давлением;
- в сочетании с гиперкортицизмом — повышенным уровнем глюкокортикоидов.
По тяжести течения:
- лёгкое — бессимптомная форма или с редкими кризами;
- среднее — частые кризы, но без осложнений;
- тяжёлое — осложнения со стороны почек, сердечно-сосудистой и центральной нервной системы, развитие сахарного диабета.
Осложнения феохромоцитомы
- острое нарушение мозгового кровообращения; ;
- отёк лёгких;
- во время беременности: отслойка плаценты, гипоксия и задержка роста плода, его смерть и/или матери.
Помимо осложнений, причиной летального исхода при феохромоцитоме может стать распространение опухолевого процесса в другие органы. Чаще всего феохромоцитома метастазирует в кости и печень.
Диагностика феохромоцитомы
Лабораторные анализы
Самый надёжный лабораторный тест для выявления феохромоцитомы — определение уровня метанефринов мочи [11] . Для подтверждения диагноза феохромоцитомы значение метанефрина или норметанефрина должно минимум в два раза превышать верхнюю границу нормы. Однако его незначительное повышение может быть ложноположительным, особенно на фоне приёма метилдопы и лабеталола.
В большинстве случаев причиной ложноположительного результата является нарушение техники проведения исследования, что требует повторной сдачи анализов. При повторном незначительном повышении метанефринов возможно проведение подавляющего теста с клонидином [10] .
Инструментальные методы исследования
Для визуализации феохромоцитомы применяется компьютерная томография (КТ) и магнитно-резонансная томография (МРТ).
Также используется функциональная визуализация с помощью сцинтиграфии 123I-МИБГ (с метайодбензилгуанидином). При сцинтиграфии в организм вводят радиоактивные изотопы, испускаемое ими излучение позволяет получить двухмерное изображение.
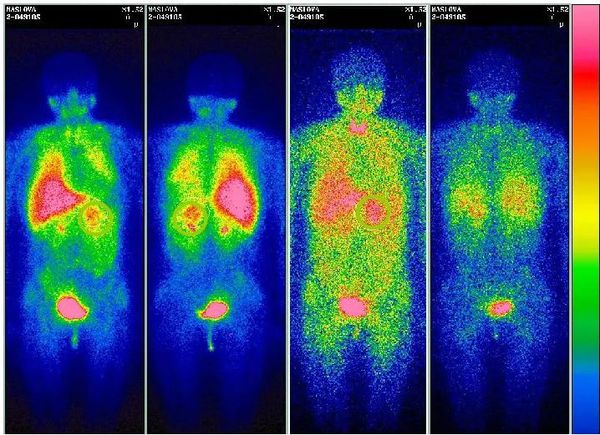
Метод обладает высокой чувствительностью и специфичностью и помогает подтвердить диагноз в спорных случаях. Он предпочтителен для выявления метастазов феохромоцитомы или дополнительных параганглиом — опухолей вненадпочечниковой ткани, выделяющих катехоламины.
Новое направление функциональной диагностики — позитронно-эмиссионная томография (ПЭТ/КТ) с препаратами 18F-FDOPA и 68Ga-DOTATATE. С их помощью можно обнаружить даже микроскопические опухоли, но эти методы ещё изучаются и широко не распространены.
Генетические тесты при феохромоцитоме
Наследственные мутации присутствуют у 30–100 % больных феохромоцитомой. По этой причине генетические исследования рекомендовано проводить всем пациентам с этой опухолью, и особенно беременным женщинам — это позволит информировать их о риске передачи ребёнку повреждённого гена [13] [14] .
Современные технологии позволяют выполнить экстракорпоральное оплодотворение (ЭКО) с генетической диагностикой до имплантации и исключить рождение ребёнка с мутантным геном [12] .
Дифференциальная диагностика
Проводится, прежде всего, с гипертонической болезнью , которая возникла по неизвестной причине. Чётких симптомов, позволяющих их различить, нет.
Лечение феохромоцитомы
Медикаментозное лечение
Лечение феохромоцитомы только хирургическое. Медикаментозная терапия используется для подготовки к операции. Для этого минимум за 10 – 14 дней до неё назначают безопасные селективные α-адреноблокаторы. Цель лечения — постепенно снизить артериальное давление, при необходимости плавно увеличивая дозу препарата [7] [11] [18] . Если, несмотря на приём α-адреноблокаторов, тахикардия сохраняется, то назначают β-адреноблокаторы или блокаторы кальциевых каналов.
По возможности следует прекратить приём глюкокортикоидов, опиоидов, метоклопрамида, тиопентала, кетамина и эфедрина, так как они могут спровоцировать гипертонический криз [10] [21] .
Для лечения метастазов феохромоцитомы показана терапия радиоактивными изотопами, а именно 131I-МЙБГ (метайодбензилгуанидином, меченным йодом-131).
В большинстве случаев можно применять радиотаргетную терапию препаратами 177Lu-DOTA-octreotate и 90Y-DOTA-octreotate. В отличие от химиотерапии, которая воздействует на все клетки организма, таргетное лечение блокирует только определённые факторы роста опухоли.
Хирургическое лечение
Для хирургического лечения используется адреналэктомия — удаление одного или обоих надпочечников. Операция может проводиться:
- ретроперитонеоскопическим доступом — хирургические инструменты вводятся через поясничную область без вскрытия брюшной полости;
- лапароскопическим — через небольшие разрезы.
При больших размерах опухоли, метастазах и опухолевых тромбах допустима открытая операция. При выявлении двухсторонних феохромоцитом для снижения риска осложнений адреналэктомию можно выполнять в два этапа с интервалом в 2 – 3 месяца [26] .
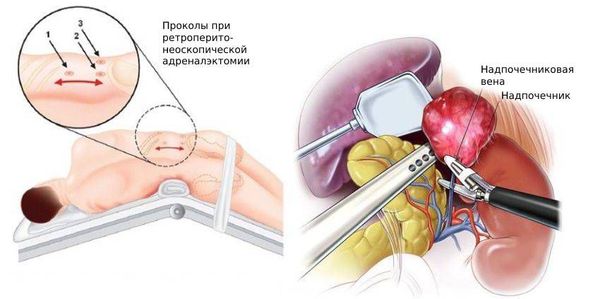
После двухсторонней адреналэктомии пациенты вынуждены пожизненно принимать заместительную терапию — глюкокортикоиды.
Противопоказания к операции
Удалить опухоль нельзя лишь в одном случае — когда она неоперабельная, то есть проросла в соседние органы, сосуды, имеется множество метастазов. В такой ситуации показана симптоматическая терапия, направленная на снижение артериального давления.
Прогноз. Профилактика
Прогноз зависит от возможности удалить феохромоцитому и её генетического профиля. Единственный надёжный метод лечения — полное удаление опухоли.
Наследственные мутации SDHB связаны с самым высоким риском метастазирования, имеют худший прогноз и более низкую продолжительность жизни, чем другие генетические нарушения.
Если феохромоцитома выявлена и удалена до того, как распространилась на другие органы, пятилетняя выживаемость составляет 95 %, при появлении метастазов — 34–60 % и, как правило, менее пяти лет, если они поражают печень или лёгкие [15] .
Местное распространение опухоли является плохим прогностическим фактором, её неполное удаление или разрушение капсулы при операции может привести к рецидиву.
Поэтому до операции запрещено проводить биопсию любых новообразований надпочечников, чтобы не повредить капсулу опухоли, если она окажется феохромоцитомой.
Раннее генетическое тестирование на наследственные мутации поможет подобрать подходящие таргетные методы лечения метастазов.
Профилактика заболевания не разработана. Генетические тесты могут выявить мутантные гены, повышающие вероятность развития феохромоцитомы, а технология ЭКО поможет не передать их потомству.
Феохромоцитома ( Хромаффинома )
Феохромоцитома – это опухоль с преимущественной локализацией в мозговом веществе надпочечников, состоящая из хромаффинных клеток и секретирующая большие количества катехоламинов. Феохромоцитома проявляется артериальной гипертензией и катехоламиновыми гипертоническими кризами. С целью диагностики феохромоцитомы проводят провокационные пробы, определение содержания катехоламинов и их метаболитов в крови и моче, УЗИ надпочечников, КТ и МРТ, сцинтиграфию, селективную артериографию. Лечение феохромоцитомы заключается в выполнении адреналэктомия после соответствующей медикаментозной подготовки.
МКБ-10
Общие сведения
Феохромоцитома (хромаффинома) – доброкачественная или злокачественная гормонально-активная опухоль хромаффинных клеток симпатико-адреналовой системы, способная продуцировать пептиды и биогенные амины, включая норадреналин, адреналин, дофамин. В 90% наблюдений феохромоцитома развивается в мозговом слое надпочечников; у 8% пациентов локализуется в области аортального поясничного параганглия; в 2% случаев – в грудной или брюшной полости, в малом тазу; крайне редко (менее 0,1%) – в области головы и шеи.
В клинической эндокринологии описаны феохромоцитомы с интраперикардиальной и миокардиальной локализацией, с преимущественным расположением в левых отделах сердца. Обычно феохромоцитома выявляется у лиц обоего пола в возрасте 20-40 лет; у детей чаще встречается среди мальчиков (60% наблюдений). Феохромоцитома является частой причиной артериальной гипертонии и выявляется примерно в 1% случаев у больных с устойчиво повышенным диастолическим артериальным давлением.
Злокачественные феохромоцитомы составляют менее 10% случаев, они, как правило, имеют вненадпочечниковую локализацию и продуцируют дофамин. Метастазирование злокачественных феохромоцитом происходит в регионарные лимфоузлы, мышцы, кости, печень и легкие.

Причины феохромоцитомы
Довольно часто феохромоцитома является компонентом синдрома множественных эндокринных неоплазий 2А и 2В типов, наряду с медуллярной карциномой щитовидной железы, гиперпаратиреозом и нейрофиброматозом. В 10% случаев наблюдается семейная форма заболевания с аутосомно-доминантным типом наследования и высокой степенью вариабельности в фенотипе. В большинстве случаев этиология хромаффинных опухолей остается не известной.
Патогенез
Клиническая симптоматика феохромоцитомы связана с действием на организм избыточно продуцируемых опухолью катехоламинов. Кроме катехоламинов (норадреналина, адреналина, дофамина) феохромоцитома может секретировать АКТГ, кальцитонин, серотонин, соматостатин, вазоактивный интестинальный полипептид, сильнейший вазоконстриктор — нейропептид Y и другие активные вещества, вызывающие многообразные эффекты.
Феохромоцитома представляет инкапсулированную опухоль с хорошей васкуляризацией, размером около 5 см и средней массой до 70 г. Встречаются феохромоцитомы как больших, так и меньших размеров; при этом степень гормональной активности не зависит от величины опухоли.
Симптомы феохромоцитомы
Наиболее постоянным симптомом феохромоцитомы служит артериальная гипертензия, протекающая в кризовой (пароксизмальной) или стабильной форме. Во время катехоламинового гипертонического криза АД резко повышается, в межкризовый период держится в пределах нормы или остается стабильно повышенным. В некоторых случаях феохромоцитома протекает без кризов с постоянно высоким АД.
Гипертонический криз при феохромоцитоме сопровождается сердечно-сосудистыми, желудочно-кишечными, нервно-психическими проявлениями, обменными нарушениями. Развитие криза характеризуется беспокойством, чувством страха, дрожью, ознобом, головной болью, бледностью кожных покровов, потливостью, судорогами. Отмечаются боли в сердце, тахикардия, нарушение ритма; возникают сухость во рту, тошнота и рвота. Характерными изменениями со стороны крови при феохромоцитоме служат лейкоцитоз, лимфоцитоз, эозинофилия, гипергликемия.
Криз может продолжаться от нескольких минут до 1 и более часов; типично его внезапное окончание с резким снижением АД вплоть до гипотензии. Завершение пароксизма сопровождается профузным потоотделением, полиурией с выделением до 5 л светлой мочи, общей слабостью и разбитостью. Кризы могут провоцироваться эмоциональными расстройствами, физической нагрузкой, перегреванием или переохлаждением, проведением глубокой пальпации живота, резкими движениями тела, приемом лекарственных препаратов или алкоголя и другими факторами.
Частота возникновения приступов различна: от одного в течение нескольких месяцев до 10 – 15 в день. Исходом тяжелого криза при феохромоцитоме может явиться кровоизлияние в сетчатку глаза, инсульт, отек легких, инфаркт миокарда, почечная недостаточность, расслаивающая аневризма аорты и др. Злокачественная феохромоцитома (феохромобластома) сопровождается болями в животе, значительным похуданием, метастазирование в отдаленные органы.
Осложнения
Наиболее тяжелым осложнением клинического течения феохромоцитомы служит катехоламиновый шок, проявляющийся неуправляемой гемодинамикой — беспорядочной сменой эпизодов гипер- и гипотензии, не поддающихся коррекции. У беременных феохромоцитома маскируется под токсикозы беременности, преэклампсию и эклампсию и часто приводит к неблагоприятному исходу родов.
Стабильная форма феохромоцитомы характеризуется стойко высоким АД с постепенным развитием изменений со стороны почек, миокарда и глазного дна, изменчивостью настроения, повышенной возбудимостью, утомляемостью, головными болями. Обменные нарушения (гипергликемия) у 10 % больных приводят к развитию сахарного диабета. Заболеваниями, часто сопутствующими феохромоцитоме, являются ЖКБ, болезнь Реклингхаузена (нейрофиброматоз), синдром Иценко-Кушинга, синдром Рейно и др.
Диагностика
При оценке физикальных данных пациентов с феохромоцитомой обращает внимание повышение АД, ортостатическая гипотония, тахикардия, бледность кожи лица и груди. Попытка пальпации объемного образования в брюшной полости или в области шеи может спровоцировать катехоламиновый криз. У 40% пациентов с артериальной гипертензией обнаруживается гипертоническая ретинопатия различной степени, поэтому больные с феохромоцитомой должны быть проконсультированы офтальмологом. Диагностический стандарт включает:
- Лабораторные исследования. Биохимическими критериями феохромоцитомы служат повышение содержания катехоламинов в моче, катехоламинов в крови, хромогранина А в сыворотке крови, глюкозы крови, в некоторых случаях — кортизола, кальцитонина, паратиреоидного гормона, АКТГ, кальция, фосфора и др.
- Фармакопробы. Важное дифференциально-диагностическое значение имеют провокационные и супрессивные фармакологические пробы. Тесты направлены либо на стимуляцию секреции катехоламинов феохромоцитомой, либо на блокирование периферического вазопрессорного действия катехоламинов, однако при проведении проб можно получить как ложноположительные, так и ложноотрицательные результаты.
- Методы инструментальной диагностики. С целью топической диагностики феохромоцитомы выполняются УЗИ надпочечников и томография (КТ или МРТ) надпочечников, экскреторная урография, селективная артериография почечных и надпочечниковых артерий, сцинтиграфия надпочечников, рентгеноскопия или рентгенография органов грудной клетки (для исключения внутригрудного расположения опухоли). Изменения на ЭКГ неспецифичны, разнообразны и обычно носят временный характер, обнаруживаясь во время приступов.
Дифференциальную диагностику феохромоцитомы проводят с гипертонической болезнью, неврозами, психозами, пароксизмальной тахикардией, тиреотоксикозом, заболеваниями ЦНС (инсультом, преходящей ишемией головного мозга, энцефалитом, ЧМТ), отравлениями.
Лечение феохромоцитомы
Консервативная терапия
Основной метод лечения феохромоцитомы – хирургический. Пред планированием операции проводится медикаментозное лечение, направленное на снятие симптомов криза, уменьшения тяжести проявлений заболевания. Для снятия пароксизмов, нормализации АД и купирования тахикардии назначают сочетание a-адреноблокаторов (феноксибензамин, тропафен, фентоламин) и b-адреноблокаторов (пропранолол, метопролол). При развитии гипертонического криза показано введение фентоламина, нитропруссида натрия и др. При злокачественной феохромоцитоме с распространенными метастазами назначается химиотерапия (циклофосфамид, винкристин, дакарбазин).
Хирургическое лечение
В ходе операции по поводу феохромоцитомы используется только лапаротомический доступ ввиду высокой вероятности множественных опухолей и вненадпочечниковой локализации. На протяжении всего вмешательства осуществляется контроль гемодинамики (ЦВД и АД). Обычно при феохромоцитоме выполняется тотальная адреналэктомия. Если феохромоцитома является частью множественной эндокринной неоплазии, прибегают к двусторонней адреналэктомии, что позволяет избежать рецидивов опухоли на противоположной стороне.
Обычно после удаления феохромоцитомы АД снижается; в случае отсутствия снижения артериального давления следует думать о наличии эктопированной опухолевой ткани. У беременных с феохромоцитомой после стабилизации АД выполняется прерывание беременности или кесарево сечение, а затем удаление опухоли.
Прогноз
Удаление доброкачественных феохромоцитом приводит к нормализации показателей АД, регрессу патологических проявлений. 5-летняя выживаемость после радикального лечения доброкачественных опухолей надпочечников составляет 95%; при феохромобластоме – 44%. Частота рецидивов феохромоцитомы составляет около 12,5%. С целью раннего обнаружения рецидивов пациентам показано наблюдение эндокринолога с ежегодным проведением необходимого обследования.
Источник https://diseases.medelement.com/disease/%D1%84%D0%B5%D0%BE%D1%85%D1%80%D0%BE%D0%BC%D0%BE%D1%86%D0%B8%D1%82%D0%BE%D0%BC%D0%B0-%D0%BF%D0%B0%D1%80%D0%B0%D0%B3%D0%B0%D0%BD%D0%B3%D0%BB%D0%B8%D0%BE%D0%BC%D0%B0-%D0%BA%D0%BF-%D1%80%D1%84-2016/16609
Источник https://probolezny.ru/feohromocitoma/
Источник https://www.krasotaimedicina.ru/diseases/zabolevanija_endocrinology/pheochromocytoma