Новое в лечении ревматоидного артрита
В последнее время тактика лечения ревматоидного артрита значительно изменилась. Новое в лечении ревматоидного артрита – это отказ от выжидательной позиции и раннее назначение агрессивного курса терапии. Это привело к тому, что специалистами была признана обратимость патологического процесса на ранних стадиях заболевания при назначении активной терапии сразу после установления диагноза.
Врачи клиники «Парамита» используют самые современные методы и лекарственные препараты для помощи больным ревматоидным артритом, сочетая их назначение с методами восточной терапии.
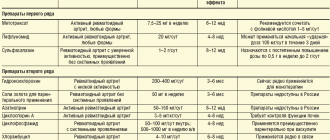
Ревматоидный артрит в цифрах
По современным представлениям ревматоидный артрит (РА) – это сложное многофакторное, хроническое, неуклонно прогрессирующее, системное аутоиммунное заболевание, в основе которого лежит длительный воспалительный процесс в организме с язвенно-деструктивным поражением и разрушением суставов.
Причины ревматоидного поражения связывают в основном с генетической предрасположенностью, вирусными инфекциями и многочисленными внешними пусковыми факторами. Код серопозитивного РА по МКБ — 10 M05.0, серонегативного — 10 M06.0.
Поражение РА населения составляет около 1% всего населения земного шара. Болеют лица любого возраста, от младенцев до пожилых людей, чаще женщины. По статистике ревматоидный артрит был установлен на 1-м году заболевания у 57,9% пациентов, остальные лечились по поводу недифференцированного (неустановленного вида) артрита (НДА), а это значит, не получали необходимой терапии. Еще через год у 33% больных этой группы был выявлен РА, то есть, их лечение замедлилось еще почти на год.
Новейшие принципы лечения РА
В последние десятилетия сформировались основные принципы терапии ревматоидных поражений, их придерживаются специалисты всего мира.
Принцип первый – ранее выявление
Лечить ревматоидные процессы непросто, результат во многом зависит от результатов обследования, установленного диагноза и предполагаемого прогноза болезни. Выявить ревматоидную патологию на ранней стадии сложно, так как похожие симптомы наблюдаются и при других заболеваниях. Поэтому очень большое значение придается выявлению РА и установлению развернутого диагноза, позволяющего сделать прогноз течения болезни у данного больного и назначить ему адекватные лечебные мероприятия.

Диагностика ревматроидного артрита
Диагноз ревматоидного артрита ставится на основании:
- Характерных симптомов болезни.
- Данных лабораторных исследований, подтверждающих наличие РА:
- низкий гемоглобин или снижение числа эритроцитов — анемия;
- ускоренная СОЭ, высокие показатели СРБ – признак воспаления;
- наличие/отсутствие ревматоидного фактора (РФ положительный или отрицательный);
- наличие/отсутствие антител к цитруллину (АЦЦП);
- наличие в крови цитокинов, поддерживающих воспаление (ФНО альфа, ИЛ-1 и др.).
- Данных инструментальных исследований, подтверждающих диагноз:
- рентгенография — выявляется рентгенологическая стадия суставных поражений;
- МРТ – самый точный метод, позволяющий выявить нарушения, еще незаметные на рентгене;
- УЗИ – выявляются изменения суставных и околосуставных тканей.
В диагнозе обязательно отражается активность патологического процесса, она очень важна для прогноза заболевания. Индекс активности ревматоидного артрита – DAS-28 рассчитывается позволяет оценить состояние пораженных суставов и общее состояние здоровья.
ФК (функциональный класс) ревматоидного процесса позволяет оценить сохранность трудовых навыков. По степени их нарушения выделяют 4 ФК.
Диагноз должен включать в себя клиническую и рентгенологическую стадии заболевания, активность патологического процесса, наличие/отсутствие РФ и системных поражений. Это позволит подобрать больному наиболее подходящую схему лечения.
Принцип второй – раннее назначение медикаментозной терапии
Схемы лечения ревматоидного артрита нового поколения учитывают клинически подтвержденный факт, что при раннем назначении активных лечебных мероприятий патологический процесс можно остановить и даже повернуть вспять. Поэтому главной целью является раннее выявление заболевания с назначением адекватного лечения, а непосредственными задачами:
- устранение болевого синдрома;
- подавление прогрессирования заболевания болезни;
- достижение состояния стойкой ремиссии;
- предупреждение двигательных нарушений;
- повышение качества жизни больного.
Современная тактика ведения ревматоидных поражений – это агрессивная тактика, когда больному назначается комплексное лечение с максимальными дозировками основных (базисных) противовоспалительных препаратов (БПВП). При этом противовоспалительные средства подбираются по результатам обследования. Раз в квартал проводится текущее обследование с целью проверки результативности проводимой базисной терапии. В состав медикаментозной терапии обязательно вводятся биологические препараты.
Раннее назначение агрессивной медикаментозной терапии
Принцип третий – сокращение симптоматической терапии
Новое в лечении ревматоидного артрита – это еще и подход к симптоматической терапии. Сейчас отказались от стандартных схем применения обезболивающих и общих противовоспалительных средств. Их назначают строго индивидуально при наличии воспалительной боли и обязательно сочетают с приемом базисных медицинских препаратов.
Допускается даже нерегулярный прием лекарств из группы нестероидных противовоспалительных препаратов (НПВП) – их принимают по мере необходимости максимально короткими курами или одноразово, используя только один препарат этой группы. Это связано с побочными эффектами НПВП – они вызывают эрозивно-язвенные поражения желудочно-кишечного тракта (ЖКТ). Еще одна опасность применения этой группы препаратов в том, что на ранних стадиях заболевания они быстро снимают все симптомы заболевания и создают иллюзию полного выздоровления. Это часто приводит к отказу больного от дальнейших лечебных мероприятий и прогрессированию ревматоидного процесса.
Еще одна группа препаратов для лечения ревматоидных поражений – глюкокортикостероиды (ГКС). Они оказывают, как симптоматическое, так (частично) и патогенетическое действие, подавляя процесс разрастания соединительной ткани в суставах, деструкцию хрящевой и костной ткани. На первых начальных стадиях ревматоидного процесса их назначают только при наличии выраженного болевого синдрома воспалительного характера – ГКС отлично снимают воспаление и боль, после чего их отменяют.
Но есть категории больных, в основном это лица преклонного возраста, которым не подходят препараты базисной терапии. В таких случаях эту роль берут на себя ГКС, назначаемые продолжительными курсами в низких дозировках. Иногда их вводят в суставы. Назначение их требует регулярного обследования больного из-за возможных побочек: остеопороза, язвенных процессов в ЖКТ и т.д.
В последние годы препараты этой группы все чаще назначают короткими курсами в высоких дозировках (пульс-терапия). Показаниями для таких процедур лечения являются тяжелые системные поражения (сердца, печени, почек).
Принцип четвертый – двигательная активность
Она необходима для профилактики контрактур и анкилозов (снижение объема движений в суставе или его полная неподвижность), а также мышечных атрофий необходима даже в период обострений – назначается щадящий комплекс лечебной физкультур – ЛФК. По мере улучшения состояния больного нагрузки увеличиваются.
Одновременно назначаются курсы лечебного массажа и физиотерапевтических процедур, усиливающих эффект ЛФК. Для сохранения нормального положения конечности назначают ношение ортезов, но только по нескольку часов в день – постоянное ношение ортезов считается неприемлемым. Двигательная активность значительно улучшает качество жизни больных с ревматоидными поражениями.
Препараты для медикаментозного лечения
Все препараты от ревматоидного артрита делятся на симптоматические и базисные. Симптоматические – это НПВП и ГКС, а базисные – синтетические и биологические.
Лекарственные средства этой группы угнетают образование фермента циклооксигеназы (ЦОГ). ЦОГ делится на два вида: ЦОГ-2, участвующую в синтезе простагландинов, поддерживающих воспаление и боль, и ЦОГ-1, поддерживающую синтез простагландинов, стимулирующих секрецию слизи в органах пищеварения и защищающих стенки органов от различных воздействий.
Первые препараты группы НПВП — Диклофенак, Кетанов, Ибупрофен и др. эффективно подавляли оба вида ЦОГ, поэтому давали много побочных эффектов со стороны ЖКТ. Но Диклофенак и сегодня считается очень эффективным лекарством, его назначают короткими курсами для снятия боли и воспалительного процесса. Для мазей с НПВП ограничений в применении нет.

Симптоматические препараты для медикаментозного лечения
НПВП, подавляющие только ЦОГ-2 (Нимесулид, Мелоксикам), – это лекарства нового поколения. Они обладают селективным (избирательным) действием и почти не имеют побочного действия на ЖКТ при правильном применении. Они также применяются в современной практике.
Глюкокортикоидные гормоны
Глюкокортикоиды (Преднизолон, Дексаметазон, Метипред) назначаются при тяжелом течении ревматоидных процессов, сильных болях и поражении внутренних органов. В зависимости от состояния пациента эти препараты назначают или достаточно длительно малыми дозами (например, пожилым больным с противопоказаниями для базисной терапии), или короткими курсами очень большими дозами (пульс-терапия). Введение гормональных препаратов в полость сустава может приостановить его воспаление и формирование контрактуры.
Синтетические базисные противовоспалительные препараты
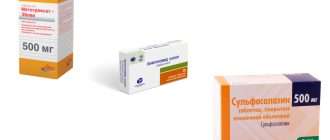
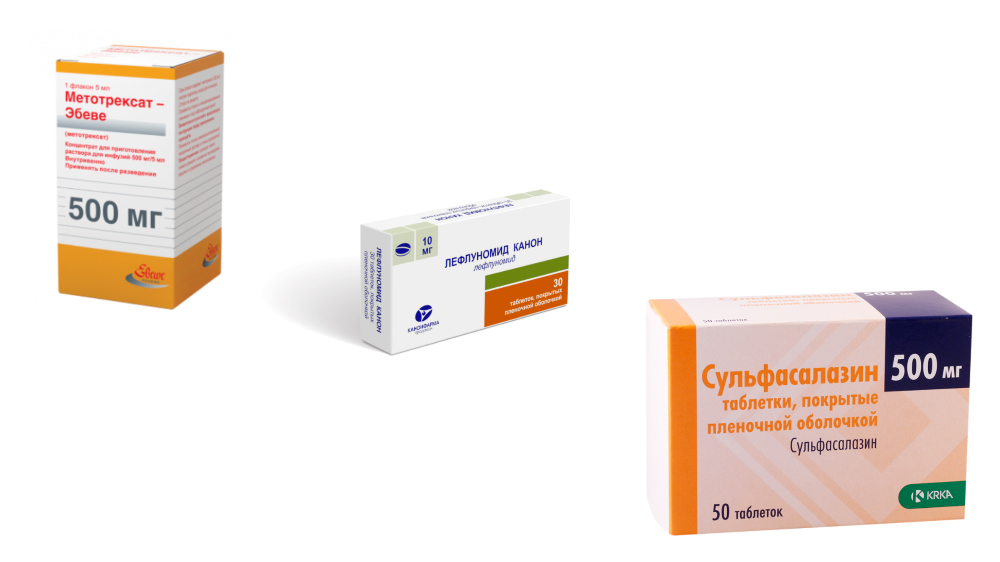
Синтетические базисные препараты применяются достаточно давно, но не потеряли своей актуальности. Курс начинается с назначения одного препарата этой группы. При высокой активности РА лечение начинают с Метатрексата, при средней и небольшой – с Сульфасалазина или Плаквенила. За эффективностью терапии тщательно наблюдают и если эффект есть, но недостаточный, присоединяют еще один базисный препарат (синтетический или биологический). Если эффекта нет, препарат меняют.
- БПВП первого ряда – назначаются в первую очередь:
- Метотрексат – считается «золотым стандартом» лечения РА базисными средствами; оптимальное сочетание лечебного действия и побочных эффектов; механизм действия связан с подавлением иммунных и воспалительных процессов, а также разрастания клеток соединительной ткани в синовиальной оболочке и разрушения хрящевой ткани; назначается длительными курсами до 4 – 5 лет; хорошо сочетается с Сульфасалазином, а еще лучше с Лефлуномидом;
- Сульфасалазин – таблетки с противовоспалительным и противомикробным действием;
- Лефлуномид — лекарство нового поколения этой группы; препарат тормозит активацию иммунной системы, оказывает противовоспалительное действие, подавляет процесс разрушения суставов.
- БПВП второго ряда – назначаются, если не подходят препараты 1-го ряда или в сочетании с ними. Это препараты:
- Плаквенил;
- Тауредон (соли золота);
- Циклоспорин А;
- Азатиоприн;
- Циклофосфамид.
БПВП первого ряда для лечения ревматроидного артрита
Биологические (генно-инженерные) БПВП – биологические агенты
Это новый метод лечения ревматоидного артрита. Лекарства данной группы — препараты нового поколения, оказывающие прицельное действие на провоспалительные (поддерживающие ревматоидное воспаление) цитокины (ИЛ-1, ФНО- альфа) или на рецепторы иммунных клеток лимфоцитов. Избирательность действия этих препаратов нового поколения позволяет свести к минимуму их побочные эффекты:
Моноклональные антитела от ревматоидного артрита
Ревматоидный артрит — многофакторное заболевание, против которого создано несколько групп препаратов. Моноклональные антитела (МАТ) — генноинженерные лекарственные средства, являющиеся передовой разработкой современной медицинской науки, эффективно борющиеся с ревматоидным артритом и сопровождающей симптоматикой.

Что это за препараты?
Моноклональные антитела — иммуноглобулины, вырабатываемые клонированными из единой клетки-предшественника иммунными последователями. Все они выявляют специфическую чувствительность только к одному антигену — веществу, чуждому для конкретного организма, выявляющему враждебные свойства в попытках атаковать его ткани. Этот чужеродный ген может иметь белковую, полисахаридную или вирусную природу. МАТ связывают его и обезвреживают.
Вернуться к оглавлению
Механизм образования и работы

Заключительный этап производства – выращивания культур в биореакторах.
Создание моноклональных антител включает следующие этапы:
- Мышей (или других животных, которые подходят для этой процедуры), иммунизирует путем введения чужеродного вещества — антигена.
- Спустя несколько недель, проверяют у них появление иммунного ответа. О нем свидетельствует появление антител к введенному антигену.
- Если результат положительный, у мышей препарируют селезенку и готовят ее к забору клеток. Для этого орган измельчают, предварительно промыв в дистиллированной воде. В специальном аппарате производится встряхивание создавшейся массы для отделения клеток, которые понадобятся в итоге.
- Среди клеточного гомогенизата находят Т- или B-лимфоциты, от которых ожидается продукция нужных антител.
- Эти клетки перемешивают с вытяжкой, содержащей клетки спинного мозга, пораженного опухолью (миеломные). Их способность мутировать активизирует B-лимфоциты.
- В полученную суспензию добавляют ферменты и инкубируют ее в определенных химических реактивах.
- Образовавшиеся гибридные клетки выращивают на питательных средах.
- С помощью иммуноферментного анализа проверяют способность новосозданных клеточных структур выполнять свою функцию.
- Отобранные клоны клеток замораживают. Они готовы к употреблению в лечебных целях.
Менее распространенными методиками приготовления моноклональных антител является их выращивание непосредственно в теле мыши, встраивание частички гена иммунных клеток человека в генотип вируса, поражающего бактерии (бактериофага), и дальнейшие генноинженерные манипуляции. Все МАТ имеют сходные механизмы работы. Заключаются они в поиске конкретных антигенов, вызывающих заболевание и обезвреживании их.
Вернуться к оглавлению
Показания к применению
Моноклональные антитела используются в таких отраслях медицины:
- Гематологии. Для лечения болезней эритроцитарного, тромбоцитарного и лейкоцитарного ростков крови.
- Онкологии.
- Ревматологии. Для излечения ревматоидного артрита и других заболеваний аутоиммунной природы.
- Неврологии. С помощью них терапии подается рассеянный склероз.
- Пульмонологии.
- Дерматологии. Проводится лечение псориаза.
- Трансплантологии. Для торможения реакции отторжения трансплантата.
Механизм действия МАТ при ревматоидном артрите базируется на их способности снижать возможность презентации антигенов, тормозить экспрессию цитокинов — медиаторов, которые передают межклеточные команды, а также вырабатывать автоантитела.
Вернуться к оглавлению
Способ применения моноклональных антител при ревматоидном артрите
Терапевтический курс моноклональными антителами при ревматоидном артрите довольно длительный. Препарат вводится внутривенно, капельно. Дозы моноклональных антител ревматолог определяет после получения результатов анализов антигенного состава синовиальной жидкости воспаленных суставов. Они подбираются индивидуально для каждого пациента. Введение МАТ позволяет прекратить прием нестероидных противовоспалительных препаратов (НПВП), глюкокортикоидов (ГКК), употребление которых имеет множество побочных эффектов.
Вернуться к оглавлению
Классификация лекарств
Моноклональные антитела делятся по принципу принадлежности к Т- или B-клеткам иммунитета:
- Последователи Т-лимфоцитов: «Натализумаб», «Даклизумаб», «Алемтузумаб», «Устекинумаб».
- Клоны В-лимфоцитов: «Ритуксимаб», «Окрелизумаб», «Офатумумаб», «Акцепт».
Самая распространенная классификация моноклональных антител базируется на способах их получения:
- Мышиные. В результате приготовления препарата используется 100% белка клеток этих животных.
- Химерические. Протеиновый, компонент, полученный от мышей, составляет 25% в общей концентрации.
- Гуманизированные. Этот показатель составляет от 5 до 10%, остальные белки принадлежат человеку.
- Человеческие. От людей происходит 100%.
Мышиные, химические и гуманизированные моноклональные антитела составляют один препарат — «Инфликсимаб». Среди человеческих МАТ есть несколько лекарственных средств, применяемых для лечения ревматоидного артрита — «Адалимумаб», «Голимумаб». Моноклональные антитела — «золотой стандарт» в борьбе с артритом и другими ревматологическими и аутоиммунными заболеваниями.
catad_tema ревматоидный артрит СтатьиКомментарии
Материалы совещания экспертов по регистру пациентов с ревматоидным артритом, получающих ритуксимаб (Мабтеру):
Опубликовано в журнале:«Научно-практическая ревматология» 2008, приложение к № 1, С. 11-14
Патология Т-клеточных иммунных реакций в течение нескольких десятилетий считается основной в развитии РА. Однако, за последние годы выяснено, что В-клетки могут участвовать в патогенезе РА не только как продуценты аутоантител (в частности, ревматоидного фактора — РФ), но и как антиген-презентирующие клетки — представляя артритогенный аутоантиген Т-клеткам. В результате Т-клетки активируются и продуцируют провоспалительные цитокины. Важная роль В-клеток в развитии ревматоидного процесса подтверждается также лечебным эффектом анти-В-клеточного препарата ритуксимаб при РА.
Ритуксимаб представляет собой химерное моноклональное антитело к молекуле СD20, находящейся на поверхности пре-В-клеток и зрелых В-клеток, но отсутствующей на стволовых клетках и на продуцентах антител — плазматических клетках. Введение препарата ритуксимаб, применяемого в течение 10 лет для лечения лимфом, приводит к быстрому и глубокому (почти до нуля) падению числа В-клеток в периферической крови, длящемуся до 6 месяцев и более.
Проведенные исследования показали высокую эффективность и хорошую переносимость ритуксимаба у больных с тяжелым РА, у которых предшествующая терапия МТХ и блокаторами ФНО оказалась неэффективной.
В заявлении-консенсусе 2007 г. указывается, что целесообразность назначения ритуксимаба может рассматриваться не только после неэфективности предшествующего лечения блокаторами ФНО-α, но и при наличии противопоказаний к этим средствам. Таким образом, признается, что ритуксимаб может быть первым среди биологических препаратов, назначаемых больному РА. У больных РА с сопутствующей В-клеточной лимфомой (в том числе в прошлом) ритуксимаб является препаратом выбора.
С сентября 2006 года ритуксимаб разрешен для лечения РА в России, и в апреле 2007 года был создан Российский регистр больных РА, получающих этот препарат. Данное сообщение представляет собой анализ первых результатов применения ритуксимаба в России. Мы полагаем, что наш опыт окажется полезным для ревматологов, которым предстоит работать с этим препаратом.
Материал и методы.
К настоящему времени один полный курс лечения ритуксимабом (2 инфузии) получили 42 больных РА (социальный статус больных представлен на диаграмме 1). Среди них было 38 женщин и 4 мужчины; средний возраст составил 50,1±10,4 лет, средняя длительность заболевания -8,5±6,2 лет. Серопозитивных по ревматоидному фактору (РФ) было 39 больных (93%). II рентгенологическая стадия РА диагностирована у 15 пациентов, III — у 24 и IV — у 3. Функциональная недостаточность суставов I степени была у 2 больных, II — у 35 и III — у 5. У 35 пациентов (83%) отмечались системные проявления (диаграмма 2). Клиническая характеристика больных представлена в таблице 1. Предшествующая терапия показана на диаграмме 3.
Диаграмма 1. Социальный статус пациентов
Диаграмма 2. Системные проявления РА
Таблица 1. Клиническая характеристика больных
Диаграмма 3. Предшествующая терапия
Конкретными показаниями к назначению ритуксимаба были: неэффективность инфликсимаба у 4 пациентов, его непереносимость у 6, неэффективность предшествующей традиционной базисной терапии у 25 (в том числе двумя и более базисными препаратами, включая метот-рексат, у 22), непереносимость предшествующей базисной терапии у 5, высокая лабораторная активность у 1. Одной больной с ранним РА ритуксимаб был назначен в качестве первого базисного препарата с целью возможно более быстрого достижения ремиссии.
В качестве основного показателя лечебного эффекта ритуксимаба была избрана динамика показателя DAS28. Отдельно учитывались также уровень В-клеток (СD19+), РФ, С-реактивного белка (СРБ), иммуноглобулинов (Ig) M, A и G, стандартные гематологические показатели.
Большинству пациентов (37) ритуксимаб вводился по классической схеме: 2 внутривенных инфузии по 1000 мг с интервалом 2 недели. Перед каждым введением проводилась премедикация — 100 мг метилпреднизолона внутривенно капельно. Пять пациентов получили 2 инфузии ритуксимаба по 500 мг каждая.
Результаты и обсуждение.
Назначение ритуксимаба привело к резкому падению уровня В-клеток в периферической крови у всех больных, которым оценивался данный показатель, до очень низкого уровня, близкого к нулю; в препаратах определялись лишь единичные клетки (диаграмма 4).
Диаграмма 4. Динамика уровня В-клеток (CD 19) при лечении ритуксимабом
В результате проведенной терапии наблюдался значительный положительный эффект, наиболее отчетливо проявившийся в динамике числа воспаленных (ЧВС) и болезненных (ЧБС) суставов. Эти показатели достоверно снизились уже к 8-й неделе. Затем они продолжали неуклонно снижаться в течение дальнейшего периода наблюдения и достигли очень низких величин к 24-й неделе (диаграмма 5).
Диаграмма 5. Динамика числа воспалённых (ЧВС) и болезненных (ЧБС) суставов
Заметно снизились также лабораторные показатели воспалительной активности — СОЭ и СРБ (диаграммы 6 и 7). Особенно следует отметить значительное и сравнительно быстрое уменьшение титра РФ (диаграмма 8), несмотря на отсутствие достоверного снижения уровня IgМ (диаграмма 9), к которому относится стандартно определяемый РФ. Это обстоятельство в некоторой степени подтверждает предположение о более выраженном разрушении ритуксимабом В-клеток, продуцирующих аутоантитела. Содержание IgA и показателей периферической крови (диаграмма 10) не претерпело изменений. В то же время уровень IgG к 16-й неделе достоверно снизился. Таким образом, нельзя полностью исключить влияние ритуксимаба на количество или функцию плазматических клеток, несмотря на то, что на них отсутствует антиген CD20.
Диаграмма 6. Динамика СОЭ
Диаграмма 7. Динамика концентрации СРБ
Диаграмма 8. Динамика ревматоидного фактора
Диаграмма 9. Динамика уровня иммуноглобулинов
Диаграмма 10. Динамика показателей периферической крови
При индивидуальной оценке эффективности терапии было отмечено постепенное нарастание положительных результатов. Так, по критерию DAS28 хороший и удовлетворительный результаты через 8 недель регистрировались у 62% больных, через 16 недель — у 86%, а через 24 недели — 100% (диаграмма 11). Относительно медленное и постепенное развитие клинического улучшения при назначении ритуксимаба соответствует гипотезе о том, что основным механизмом лечебного действия этого препарата является торможение антиген-представляющей функции В-клеток.
Диаграмма 11. Оценка эффективности терапии по критериям EULAR через 8 (n=34), 16 (n=14) и 24 (n=8) недели (%)
Обращает внимание, что эффект терапии не обнаружил параллелизма с выраженностью снижения уровня В-клеток. По-видимому, снижение их уровня само по себе еще не является достаточным условием для развития клинического улучшения при РА.
Переносимость ритуксимаба была хорошей. В основном регистрировались только инфузионные реакции в виде отека лица и заложенности носа у одного пациента, парестезий верхних дыхательных путей у 2 больных, гиперемии и зуда ушных раковин у 2, гриппоподобного синдрома у 2 пациентов. У одной больной с сердечной недостаточностью I стадии после 2-й инфузии наблюдалось усиление одышки и болей в области сердца.
Таким образом, применение ритуксимаба для лечения РА не только открыло новое направление в антиревматической биологической терапии, но и расширило представления о патогенезе этого заболевания, подчеркнув важную роль В-клеток. Этот препарат заслуживает широкого применения при лечении тяжелых больных РА, рефрактерных к предшествующей терапии, включая блокаторы ФНО-а. Его переносимость оказалась вполне удовлетворительной.
Ближайшими задачами в исследовании ритуксимаба являются разработка показаний к проведению его повторных курсов и оценка его антидеструктивного действия.
1 апреля 2008 г.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ) Если Вы медицинский специалист, войдите или зарегистрируйтесь Связанные темы: ревматоидный артритСовременные возможности профилактики и лечения острых респираторных инфекций у детей, больных полиартикулярной формой ювенильного ревматоидного артрита Список литературы:
Генно-инженерная биологическая терапия
Генно-инженерные биологические препараты (ГИБП) — инновационный способ лечения РА. Рассказываем, как эта терапия останавливает воспаление и развитие РА, но при этом не угнетает работу иммунитета целиком.

Генно-инженерные биологические препараты — это лекарственные препараты на основе белковых молекул, созданные с помощью методов генной инженерии и применяющиеся для лечения ревматоидного артрита. ГИБП точечно воздействуют на определенные звенья иммунной системы, отвечающие за патологические процессы, но при этом не тормозят работу всего иммунитета. Рассказываем, что такое ГИБП, как они работают и какие препараты используют сегодня для лечения ревматоидного артрита в России.
Что такое ГИБП
Клетки организма передают друг другу сигналы с помощью белков, которые называются цитокинами. Можно сказать, что цитокины — язык, на котором клетки разговаривают друг с другом. Чтобы цитокин мог передать сигнал клетке, он должен связаться со специфическими рецепторами на ее мембране. Если цитокин будет находиться возле клетки, но не свяжется с рецепторами, клетка не получит сигнал.
Цитокины, которые запускают реакции воспаления, называются провоспалительными цитокинами. Ключевыми провоспалительными цитокинами в развитии ревматоидного артрита являются интерлейкин-6 и ФНОα.
Генно-инженерные биологические препараты (ГИБП) блокируют сами цитокины или рецепторы, через которые цитокины связываются с клеткой. А также ингибируют патологическую активацию Т-лимфоцитов и В-лимфоцитов, которые участвуют в патогенезе ревматоидного артрита. В зависимости от механизма действия можно выделить 4 группы ГИБП:
- ингибиторы рецепторов к ИЛ-6 или самого ИЛ-6;
- ингибиторы ФНОα, или рецепторы, которые конкурентно связываются с ФНОα;
- антитела к CD20-рецептору на В-лимфоцитах;
- блокаторы ко-стимуляции (активации) Т-лимфоцитов.
Как получают ГИБП
При ревматоидном артрите иммунная система атакует собственные ткани организма. Такой патологический процесс представляет собой сложные реакции иммунной системы с участием разных иммунных клеток. Подавить патологическую активацию иммунитета можно несколькими способами. Один из них — это разрушить иммунные клетки. Другой способ — заблокировать те реакции, которые приводят к поддержанию хронического воспалительного процесса и нарушениям со стороны органов и тканей.
Это можно сделать с помощью сложных белковых молекул, которые получают методом генной инженерии из человеческих или животных клеток. Ученые программируют клетки, чтобы они производили нужные молекулы, которые обладают определенными терапевтическими свойствами [2].
Все ГИБП, которые используются в России для лечения ревматоидного артрита, —это терапевтические моноклональные антитела или рекомбинантные белки. Антитело — белковая молекула, которую организм производит в норме, чтобы обезвредить чужеродное вещество, например вирус или бактерию. Терапевтические антитела связываются с теми компонентами иммунной системы, которые отвечают за развитие заболевания и таким образом прерывают каскад патологических реакций. В статье про лечение мы подробно рассказали о том, как работают другие группы препаратов при ревматоидном артрите.
Как врач назначает ГИБП
Обычно врачи назначают ГИБП в комбинации с базисными противовоспалительными препаратами (БПВП) — это дает лучший лечебный эффект. Но, если пациент плохо переносит БПВП или у него есть противопоказания, врач может оставить только ГИБП для монотерапии — лечения одним препаратом [1, 9].
Каждое заболевание имеет свои особенности, а каждое лекарство — противопоказания. Поэтому только лечащий врач может правильно подобрать препарат, который будет эффективен для конкретного пациента.
В целом все ГИБП обладают сходным профилем безопасности. Во время лечения могут развиться нежелательные реакции в связи с иммуносупрессивным действием препаратов. Например, повышенный риск инфекций, подавление продукции клеток крови в костном мозге, аллергические реакции и т. д. Чтобы этого избежать, перед назначением ГИБП врач проводит пациенту ряд обследований [1]:
- общий и биохимический анализ крови, исследование крови на инфекции;
- скрининг на туберкулез (рентгенография или компьютерная томография органов грудной клетки, кожные пробы или анализы крови на туберкулез);
- а также другие обследования в соответствии с клинической ситуацией.
Комментарий эксперта: генно-инженерные биологические препараты
Ингибиторы рецепторов к ИЛ-6
Что происходит в организме: один из ключевых цитокинов, который вызывает воспаление при ревматоидном артрите, –—это интерлейкин-6 (ИЛ-6). Эффекты ИЛ-6 можно разделить на системные и локальные [3, 9,].
- Системные: стимуляция острофазового воспалительного ответа, при котором клетки печени усиленно синтезируют острофазовые белки воспаления. Например: С-реактивный белок (СРБ), фибриноген, сывороточный амилоидный белок А (SAA), гипсидин. Эти белки отвечают за развитие таких осложнений, как вторичный амилоидоз или анемия хронического заболевания. Также ИЛ-6 стимулирует выработку лептина — гормона, который играет важную роль в развитии анорексии при хронических воспалительных заболеваниях. К проявлениям системного действия ИЛ-6 можно отнести лихорадку и утреннюю скованность.
- Локальные: ИЛ-6 участвует в процессе разрушения суставов и развития синовита — воспаления синовиальной оболочки.
Рецепторы, через которые интерлейкин может передать сигнал в клетку, бывают двух типов:
- мембранные, которые находятся на поверхности мембран клеток. Не все клетки имеют этот рецептор;
- растворимые, которые свободно плавают в кровотоке. Связавшись с растворимым рецептором, ИЛ-6 сможет передать сигнал в клетку, которая не имеет мембранного рецептора.
Как действует препарат на основе ингибиторов рецепторов ИЛ-6: препараты из группы ингибиторов рецепторов к ИЛ-6 — это антитела, которые связываются и блокируют оба типа рецепторов: как мембранные, так и растворимые. В итоге ИЛ-6 остается в кровотоке, но уже не может связываться с другими клетками и передавать им сигнал.
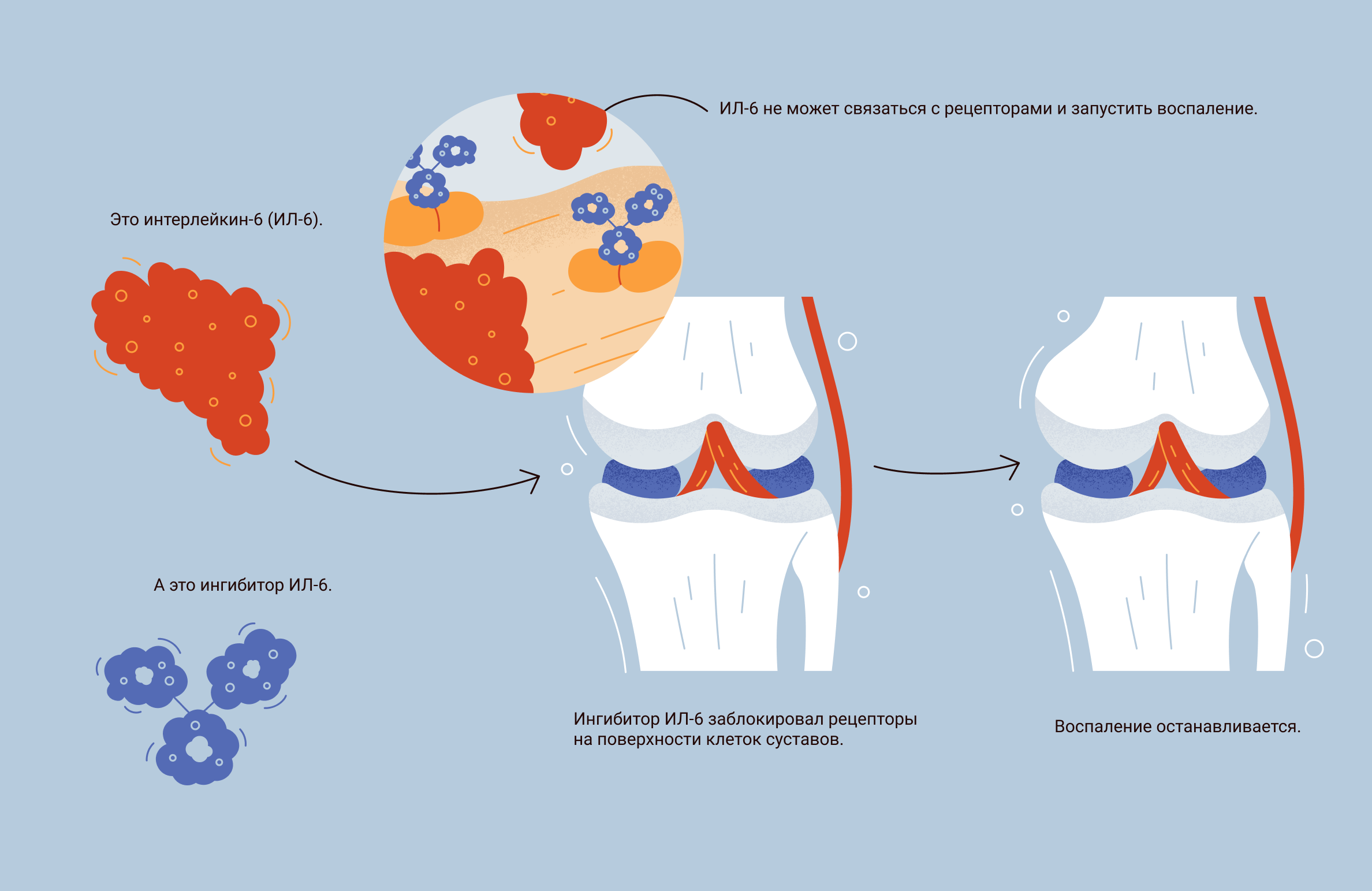
Какие препараты используют в РФ: для лечения РА используют три препарата, каждый из которых блокирует оба типа рецепторов к ИЛ-6:
- Тоцилизумаб — гуманизированное (максимально приближенное к человеческому) моноклональное антитело [1, 8].
- Сарилумаб — человеческое моноклональное антитело [1, 14].
- Левилимаб — высокогуманизированное (максимально приближенное к человеческому) моноклональное антитело [1, 13].
Ингибиторы ФНОα
Что происходит в организме: фактор некроза опухоли альфа (ФНОα) — еще один цитокин, который запускает воспалительную реакцию в организме после того, как свяжется с клеткой. В нормальных условиях такая реакция помогает победить инфекцию [5, 6]. Вот основные эффекты ФНОα в развитии ревматоидного артрита [3]:
- усиление синтеза веществ, запускающих реакцию воспаления и деструкцию суставов – — провоспалительных цитокинов, хемокинов, молекул адгезии, металлопротеиназ, коллагеназ и простагландинов;
- стимуляция ангиогенеза — образования новых кровеносных сосудов;
- увеличение выживаемости клеток соединительной ткани в синовиальной оболочке суставов — синовиальных фибробластов.
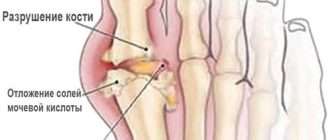
- повышение продукции фактора дифференцировки остеокластов — лиганда остеопротегерина (OPG) — RANKL. Это вещество, которое отвечает за разрушение костной ткани;
- усиление болей в суставах.
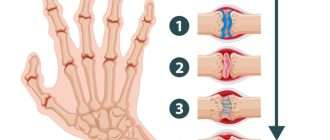
Как развивается ревматоидный артрит на клеточном и тканевом уровне
Объясняем на доступном языке, что такое провоспалительные цитокины, ревматоидный фактор, костно-фиброзный анкилоз. И как это связано с развитием ревматоидного артрита на уровне клеток и тканей.
Как действует препарат: ингибитор ФНОα — это антитело, которое связывается с молекулой ФНОα и блокирует ее. Заблокированный ФНОα не может связаться с клеткой и передать ей сигнал, а значит, не может запустить реакцию воспаления.
Какие препараты используют в РФ: для лечения ревматоидного артрита используют 5 молекул, ингибирующих ФНОα [1]:
- Инфликсимаб — химерное моноклональное антитело. Химерные антитела состоят из фрагментов разного происхождения. Так инфликсимаб примерно на 25% состоит из мышиных аминокислот и на 75% из человеческих аминокислот [9].
- Адалимумаб — человеческое моноклональное антитело [9];
- Голимумаб — человеческое моноклональное антитело [9];
- Цертолизумаба пэгол — гибридная молекула. Состоит из части антитела, которую ученые соединили с полимерным веществом —полиэтиленгликолем (ПЕГ). Благодаря этому цертолизумаба пэгол дольше находится в крови и дольше оказывает лечебный эффект [9].
- Этанерцепт — гибридная молекула. Состоит из части рецептора к ФНОα, которая соединена с фрагментом человеческого антитела. В отличие от других ингибиторов ФНОα, этанерцепт дополнительно нейтрализует лимфотоксин — еще одно вещество, вызывающее воспаление [9].
Анти-CD20 моноклональные антитела (Анти B-клеточная терапия)
Что происходит в организме: есть несколько типов иммунных клеток. Во время воспаления каждый из этих типов выполняет свои задачи. Например, у человека, болеющего ангиной, макрофаги захватывают и переваривают вредные бактерии, а тучные клетки выделяют гистамин — медиатор воспаления, который способствует развитию отека и воспаления. Лимфоциты — клетки иммунной системы, которые обеспечивают выработку антител, провоспалительных цитокинов, взаимодействие с другими клетками иммунной системы (регуляция их деятельности) и пораженными клетками, подлежащими удалению из организма. Один из типов таких иммунных клеток называется B-клетками или B-лимфоцитами. В норме, когда B-клетки сталкиваются с патогеном, например бактерией или вирусом, то начинают синтезировать против него антитела. Антитела связываются с патогеном, после чего другие иммунные клетки распознают и уничтожают этот комплекс.
При ревматоидном артрите определенные популяции B-лимфоцитов, участвующие в регуляции иммунного ответа, синтезируют широкий спектр аутоантител. Это антитела, которые атакуют собственные ткани организма. Также эти B-лимфоциты повышают синтез провоспалительных цитокинов, что приводит к повреждению тканей и активации Т-лимфоцитов. Активированные Т-лимфоциты поддерживают иммуновоспалительный процесс при РА [9].
Часть B-лимфоцитов содержит специфический белок CD20. Лекарственные препараты оказывают терапевтический эффект за счет того, что связываются с этим белком [4, 10].
Как действует препарат: молекула связывается с белком CD20 на поверхности B-клетки — это запускает ряд иммунных реакций, после которых клетка разрушается. Таким образом патологический процесс прерывается.
Препарат воздействует только на те В-лимфоциты, которые имеют рецептор CD20. Остальные В-лимфоциты не повреждаются и продолжают выполнять свои функции. Иммунная защита организма от инфекций полностью не блокируется.
Какие препараты используют в РФ:
- Ритуксимаб — химерное моноклональное антитело, которое состоит из человеческих и частично мышиных аминокислот [1, 9].
Блокатор ко-стимуляции Т-лимфоцитов
Что происходит в организме: Т-лимфоциты — еще один тип иммунных клеток, который управляет иммунным ответом. Т-лимфоциты бывают нескольких видов, каждый из которых выполняет свои функции. Вот как это работает:
- Эффекторные Т-лимфоциты (Т-хелперы и Т-киллеры) отвечают за иммунную защиту организма от инфекций. Т-хелперы активируют иммунную систему (В-клетки, моноциты) для синтеза антител, провоспалительных цитокинов и др. А Т-киллеры разрушают поврежденные клетки собственного организма.
- Регуляторные Т-лимфоциты сдерживают силу и продолжительность иммунного ответа через регуляцию активности Т-эффекторных клеток. Таким образом регуляторные Т-клетки поддерживают толерантность к собственным антигенам организма и предотвращают развитие иммуновоспалительных заболеваний [12].
При ревматоидном артрите баланс между эффекторными и регуляторными Т-лимфоцитами нарушается. Активных эффекторных Т-лимфоцитов, которые синтезируют провоспалительные цитокины и стимулируют B-лимфоциты вырабатывать аутоантитела, становится больше. Таким образом запускается иммуновоспалительный (аутоиммунный) процесс.
Чтобы Т-лимфоцит стал активным, он должен связаться с рецептором на клетке, которая передает сигнал. Если заблокировать этот рецептор с помощью лекарственного препарата, Т-лимфоцит не может получить сигнал от клетки — таким образом патологическая реакция не запускается [11].
Как действует препарат: связывает и блокирует ключевые белки на поверхности клеток, которые активируют Т-лимфоциты [9].
Источник https://clinica-paramita.ru/info/novoe-v-lechenii-revmatoidnogo-artrita/
Источник https://mcpanacea.ru/info/interesnoe/monoklonalnye-antitela-ot-revmatoidnogo-artrita
Источник https://revmo.info/treatment/genno-inzhenernaya-biologicheskaya-terapiya