Лечение бесплодия у мужчин или лечение мужского бесплодия — высокоэффективная методика!

Мужское бесплодие представляет серьезную медицинскую проблему и может приводить к проблемам в семье.
Наиболее часто при подозрении на наличие бесплодия первыми мужчин обследуют врачи-урологи. Мужское бесплодие может быть мультифакторной проблемой, требующей для ее решения привлечения специалистов смежных областей.
Рекомендации, представленные в настоящем разделе, основаны на обзоре литературы, доступной в Medline, Cochrane Central Register of Controlled Trials и списках литературы, цитированной в научных статьях и обзорах, посвященных проблеме мужского бесплодия.
Использовался контролируемый словарь базы данных Medical Subject Headings (MeSH) по протоколу «свободный текст».
Определение термина «бесплодие».
Под бесплодием понимается отсутствие в течение 1 года и более беременности у женщины в сексуально активной паре, не использующей противозачаточные средства (ВОЗ).
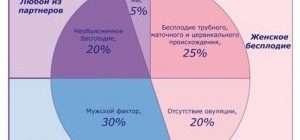
Эпидемиология и этиология (распространенность и причины) мужского бесплодия.
Приблизительно 15% сексуально активных пар не достигают беременности в течение 1 года и обращаются по этому поводу за медицинской помощью . В конечном счете 5% пар остаются бездетными, несмотря на предпринимаемые попытки лечения. У половины (50%) бездетных пар бесплодие связано с «мужским фактором», проявляющимся отклонениями в параметрах эякулята. В ряде случаев женщина с хорошей способностью к зачатию может компенсировать субфертильность мужчины, поэтому обычно бесплодие проявляется при снижении фертильности у обоих партнеров.
Фертильность мужчин может снижаться в результате следующих факторов:
- врожденные или приобретенные аномалии мочеполовых органов;
- инфекции мочеполовой системы;
- повышение температуры в мошонке (например, вследствие варикоцеле);
- эндокринные нарушения;
- генетические отклонения;
- иммунологические факторы.
По меньшей мере в 30–40% причинный фактор мужского бесплодия не выявляется (идиопатическое бесплодие). У этих пациентов в анамнезе нет проблем с фертильностью, изменений при физикальном осмотре и в лабораторных данных гормональных исследований. При этом в анализе эякулята выявляется снижение числа сперматозоидов (олигозооспермия), снижение подвижности сперматозоидов (астенозооспермия) и большое число сперматозоидов с измененной формой (тератозооспермия). Эти изменения в спермограмме часто наблюдаются одновременно и обозначаются как олигоастенотератозооспермия (ОАТ-синдром). В таблице суммированы основные факторы, ассоциированные с мужским бесплодием. Идиопатическое мужское бесплодие обычно связано с гормональными нарушениями.
Факторы, связанные с мужским бесплодием и их процентное распределение у 10 469 пациентов.
| Этиология мужского бесплодия | Распределение, % |
| Идиопатическое мужское бесплодие | 31 |
| Крипторхизм | 7,8 |
| Урогенитальные инфекции | 8,0 |
| Преждевременное семяизвержение и сексуальные факторы (эректильная дисфункция, гипоспадиии т. д.) | 5,9 |
| Общие и системные заболевания | 3,1 |
| Варикоцеле | 15 |
| Гипогонадизм | 8,9 |
| Иммунологические факторы | 4,5 |
| Обструкция (непроходимость семявыносящих протоков) | 1,7 |
| Другие нарушения | 5,5 |
Прогностические факторы мужского бесплодия.

Прогноз при мужском бесплодии при правильном лечении благоприятный.
Прогностическими факторами при мужском бесплодии и определяющими эффективность лечения мужского бесплодия являются:
- длительность бесплодия;
- первичное или вторичное бесплодие;
- данные спермограммы;
- возраст и фертильность партнерши.
В бесплодных парах с длительностью наблюдения 2 года и с олигозооспермией в качестве первичной причины бесплодия частота наступления беременности после лечения бесплодия у мужчин составляет 27% .
Во многих западных странах женщины откладывают первую беременность, мотивируя это необходимостью завершения образования, затем началом профессиональной карьеры. Возраст женщины – наиболее важный прогностический фактор, независимо влияющий на эффективность вспомогательных репродуктивных технологий. У женщин в возрасте 35, 38 и > 40 лет по сравнению с 25-летними потенциал к зачатию снижается до 50, 25 и < 5% соответственно.
- Для определения причины бесплодия необходимо проводить одновременное обследование обоих партнеров.
- При диагностике и лечении мужского бесплодия необходимо учитывать фертильный статус женщины, так как он может влиять на конечный результат.
- Уролог-андролог должен обследовать каждого мужчину с бесплодием на наличие нарушений со стороны мочеполовой сферы. Это относится ко всем пациентам со снижением качества эякулята. Для назначения соответствующего лечения (лекарственное лечение, операция, вспомогательные репродуктивные технологии) необходимо поставить диагноз и определить причину бесплодия.
Лечение мужского бесплодия на современном уровне. Эффективное лечение бесплодия у мужчин.

При мужском бесплодии правильно проведенное лечение позволяет добиться наступления беременности более чем в 70% случаев.
Лечение мужского бесплодия включает:
- Хирургическое лечение бесплодия у мужчин . Например, хирургическое лечение варикоцеле или хирургическое восстановление проходимости семявыносящих протоков.
- Лечение инфекций . Если в анализе крови имеется большое количество лейкоцитов, это может свидетельствовать о наличии в организме острого воспаления, в том числе, инфекций половых путей. Лечение антибиотиками может помочь вылечить инфекцию, но не всегда это гарантирует восстановление способности к оплодотворению.
- Лечение сексуальных проблем. Лечение заболеваний, таких как эректильная дисфункция и преждевременная эякуляция может существенно улучшить прогноз при мужском бесплодии.
- Гормональное лечения или коррекцию гормональных сдвигов, лекарственную терапию. В случае, если бесплодие у мужчины связано с высоким или низким уровнем определенных гормонов или есть проблемы с тем, как организм использует гормоны, врач может рекомендовать лечение гормонами или лекарствами, которые изменяют уровень гормонов в благоприятную для улучшения сперматогенеза сторону.
- Физиолечение. Местное использование лазерного излучения, электрофореза и фонофореза с лекарственными препаратами может существенно помочь в лечении мужского бесплодия и значительно улучшить сперматогенез.
- Вспомогательные репродуктивные технологии (ВРТ) в лечении бесплодия у мужчин. В случае неподдающейся коррекции непроходимости семявыносящих протоков, ретроградной эякуляции или других проблем с «доставкой» спермы в половые пути женщины, сперматозоиды могут быть взяты непосредственно из яичка или из мочевого пузыря и введены в яйцеклетку. Наиболее распространенной методикой является экстракорпоральное оплодотворение (ЭКО). Эта процедура включает в себя хирургическое изъятие яйцеклетки из яичника женщины, оплодотворение ее спермой в лаборатории, а затем помещение оплодотворенной яйцеклетки в матку.

Доктор Миленин — специалист по лечению мужского бесплодия.
Консультации по всем вопросам, связанным с диагностикой и лечением мужского бесплодия, лечением бесплодия у мужчин и запись на прием:
Современные возможности лечения мужского бесплодия

Мужское бесплодие — это патологическое состояние спермы, при котором мужчина становится неспособен зачать ребенка независимо от возможности совершения полового акта.
Бесплодие в семьях составляет 15-20% всех браков. Брак считается бесплодным, если в семье в течение 1 года регулярной половой жизни супругов (без предохранения) не наступает беременности. Актуальность данной проблемы относительно семьи трудно переоценить, тем более что, каждый четвертый развод происходит по причине бесплодия мужа или жены. В связи с этим обследование семейной пары по поводу бесплодия должно быть обоюдным и комплексным: мужа обследует уролог-андролог, жену — гинеколог (по возможности гинеколог-репродуктолог). Немаловажным является тот факт, чтобы андролог и гинеколог были проинформированы относительно обследования и лечения обоих супругов. Надо заметить, что конечный результат терапии бесплодия в браке во многом зависит от обьективности обследования супругов и точности установленного диагноза, а также важнейшим звеном является совместная работа и личные контакты врачей-специалистов, участвующих в лечении.
Важнейшим фактором для определения мужского фактора при бесплодии в семейной паре является выбор времени начала обследования, наиболее обьективной схемы обследования мужчины и рациональных методов лечения при необходимости. Многие семейные пары начинают переживать уже после нескольких месяцев отсутствия беременности, и в таких ситуациях не стоит продолжать ожидать наступления беременности без обследования мужа. Обследование мужчины должны проводиться всякий раз, когда пациенты обращаются с основной жалобой на невозможность зачатия. Такое обследование должно быть неинвазивным и недорогим. Интересно отметить, что в половине случаев первичного бесплодия, когда обследовалась и лечилась только жена, в спермограмме у мужа обнаруживались патологические изменения, которые могли стать причиной инфертильности.
Фертильность или оплодотворяющая способность мужчины зависит от свойств его спермы, количества и качества содержащихся в ней сперматозоидов. Сперма, эякулят (еjасulаto- извержение) — представляет собой смесь секретов яичек и их придатков, а также придаточных желез полового тракта мужчин (семенных пузырьков, предстательной железы, желез Купера и Литтре), выделившаяся при половом сношении или мастурбации. Она мутная, белесоватая опалесцирующая с желтоватым оттенком вязкая масса, состоящая из семенной жидкости (плазмы) и сперматозоидов. В состав семенной жидкости эякулята входят секреты предстательной железы и семенных пузырьков, желез Купера и Литтре. Объем эякулята зависит от индивидуальных особенностей мужчины, частоты и регулярности половых сношений. В норме количество эякулята колеблется в пределах 1-6 мл. Семя здорового мужчины имеет щелочную реакцию; его рН колеблется в пределах от 7,0 до 7,6, благодаря чему обеспечиваются нормальная подвижность сперматозоидов, их выживаемость в кислой среде влагалища женщины, где рН составляет 4,5. Активная подвижность сперматозоидов, обусловленная щелочной реакцией спермы (рН которой примерно 7,5), помогает им достигнуть матки. Зрелый и морфологически нормальный сперматозоид двигается поступательно в прямолинейном направлении, благодаря чему и происходит его встреча с женской яйцеклеткой. В 1 мл эякулята у здорового мужчины содержится от 15 до 100 млн. сперматозоидов. В нормальной сперме обычно имеется 50% и более подвижных форм сперматозоидов, от 15 до 20% неподвижных их форм, 60% и более — зрелых форм сперматозоидов. В эякуляте наряду с нормальными сперматозоидами всегда имеются аномальные, морфологически измененные формы (примерно 15-20%). Также, в семенной жидкости содержатся различные биохимические вещества, нормальная концентрация которых обеспечивает жизнеспособность и движение сперматозоидов: белки, ряд аминокислот, остаточный азот, углеводы (глюкоза, фруктоза, инозит), органические кислоты, лимонная кислота, органические основания (спермин), ферменты (фосфатаза, гиалуронидаза). Значение некоторых из этих веществ для жизнеспособности сперматозоидов доказано однозначно и не подвергается сомнению. Например, фруктоза, вырабатывающаяся в семенных пузырьках, крайне необходима сперматозоидам в качестве энергетического субстрата для проявления их подвижности. Такое вещество, как лимонная кислота, синтезирующаяся в простате, способствует разжижению эякулята, активации фермента гиалуронидазы, которая, в свою очередь, способствует своевременному проникновению спермиев в зрелую яйцеклетку.
Этиология и патогенез
По современным представлениям в репродуктологии выделяют 4 формы мужского бесплодия.
- Секреторное бесплодие, связанное с заболеванием яичек
- Экскреторное бесплодие, не связанное с заболеванием яичек.
- Смешанная форма бесплодия — сочетание секреторной и экскреторной форм.
- Идиопатическое бесплодие — состояние, когда беременность не наступает при отсутствии заболеваний половой сферы.
Первичная секреторная патология яичек может быть обусловлена врожденными пороками развития половых органов (аномалии яичек, крипторхизм, варикоцеле, синдром Клайнфельтера, синдром Дель Кастильо), отдаленными последствиями оперативного лечения (грыжесечение, орхидопексия, операции при гидроцеле и др.), инфекционно-воспалительными заболеваниями (осложненное течение эпидемического паротита в виде орхита , эпидидимит, туберкулез и др.), нарушениями алиментарного фактора (недостаточное питание, голодание), воздействием ионизирующего излучения, профессиональных интоксикаций (ртутные, фосфорные, алкоголь, и др.). Вторичные поражения яичек тесно взаимосвязаны с патологическими изменениями в тех железах, которые находятся в тесных гормональных взаимоотношениях с яичками, гипофизе, надпочечниках, щитовидной железе.
Экскреторные варианты мужского бесплодия встречаются намного чаще, чем секреторные формы и, как правило, его причинами могут становится хронические воспалительные заболевания или пороки развития половых желез, придатков яичек и семявыносящих протоков (уретриты, простатиты, везикулиты, эпидидимиты, фуникулиты, деферентиты, кисты, опухоли, стриктуры, отдельные формы гипоспадии и др.). Смешанные (экскреторно-токсические) варианты бесплодия носят многолетний приобретенный характер и, как правило, их необходимо рассматривать в контексте патологических изменений спермы в следствии инфекционно-воспалительных заболеваний малого таза.
Лечение обязательно должно исходить из этиопатогенеза заболевания
Консервативное лечение бесплодия является нелегким и достаточно долгим процессом, требующим терпения не только от врача, но и от семейной пары. Общеукрепляющие принципы терапии включают устранение профессиональных вредностей, нормализацию ритма сна и отдыха, занятия спортом, рациональное питание, ограничение алкоголя. При лечении воспалительных заболеваний мужских половых органов необходимо учитывать, что для того, чтобы добиться санации и восстановления оплодотворяющей способности спермы — порою необходимы несколько месяцев беспрерывного лечения
Консервативная терапия экскреторного и смешанных (экскреторно-токсических) форм бесплодия более перспективна, чем его секреторные формы, и во многих клинических случаях, при условии адекватного и комплексного лечения приводит к положительному результату. Если доказано наличие сперматогенеза в яичках — процесс лечения начинается с устранения экскреторно-токсических причин. Лечение идиопатического бесплодия является самым трудоемким и долгим . Режим половой жизни при бесплодии имеет свои особенности: половая жизнь без презерватива возможны в течение 3-4х дней до, после и во время предполагаемой овуляции у жены; в остальное время — использование только презерватива во избежание контакта кожи и слизистых половых органов жены со спермой мужа. При лечении верифицированного гипогонадизма часто обоснованным является применение гормонов типа гонадотропинов. С целью компенсации гипофункции передней доли гипофиза назначают препараты ФСГ (фолликулостимулирующий гормон). При недостаточности ФСГ назначают сывороточный гонадотропин и его аналоги, нередко в комбинации с препаратами тестостерона и витаминов. Если верифицирована недостаточность, назначают препараты ХГЧ, который по своему биологическому действию близок к ЛГ (лютеинизирующему гормону аденогипофиза). Его дают в течение 1,5-2 мес, проводя при необходимости (строго по показаниям) 2-4 курса стимуляции в год. При первичном гипогонадизме вследствие врожденного заболевания яичек (синдром Клайнфелтера, Дель Кастильо и др.) прогноз неблагоприятный, в таких случаях супружеским парам рекомендуется подумать о усыновлении ребенка. При безуспешности консервативной терапии или абсолютных показаниях со стороны одного из супругов нередко ставится вопрос о необходимости применения методик ВРТ.
Профилактические меры патоспермии требует проведения обширной санитарно-просветительной работы со стороны педиатров, детских урологов-андрологов, родителей. Основной мерой профилактики является раннее выявление и своевременное лечение расстройств и заболеваний половой сферы. Хирурги-урологи, выполняющие операции в пахово-мошоночной области должны помнить об отрицательном действии на сперматогенез нарушенного кровоснабжения яичек, поэтому такие операции должны выполняться строго по показаниям и максимально неинвазивно по отношению к сосудисто-нервным пучкам, имеющих отношение к яичкам. Адекватная терапия в детском и юношеском возрасте таких инфекционных заболеваний как: эпидемический паротит, токсоплазмоз, бруцеллёз и др. — является физиологической гарантией сохранения и функционирования сперматогенного эпителия яичек в репродуктивном возрасте.
СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ КОНСЕРВАТИВНОГО ЛЕЧЕНИЯ МУЖСКОГО БЕСПЛОДИЯ
- Cекреторная форма
- Экскреторно-токсическая
- Сочетанное (секреторная + экскреторно-токсический вариант) или смешанное
Cекреторная форма
Наиболее трудным и сложным для лечения является секреторная форма мужского бесплодия, в основе которого лежат различные формы гипогонадизма.Среди них первичный (гипергонадотропный) гипогонадизм составляет 97-98%, и только 2-3% — вторичный (гипогонадотропный) гипогонадизм. В целом, истинно секреторные нарушения сперматогенеза составляют около 10 % в структуре мужского бесплодия.
Эффективность и прогноз лечения секреторной формы полностью зависит от исходного состояния сперматогенного эпителия яичек к началу лечения.
- Полностью бесперспективными в плане восстановления фертильности являются врождённые, генетически детерминированные формы первичного гипогонадизма (синдром Клайнфельтера, синдром Дель Кастильо, синдром анорхизма, патология полового аппарата, связанная с нарушением половой дифференцировки).
- Прогностически благоприятными в плане восстановления репродуктивного потенциала являются приобретённые первичные формы гипогонадизма. Приобретённые до пубертатного периода ( вследствии травмы яичек, лучевой терапии, перенесенного орхита или эпидидимита и др.) такие формы гипогонадизма клинически протекают с тяжёлыми изменениями спермограммы вплоть до азооспермии или олигозооспермии IV степени. В дальнейшем, при условии сохраненного потенциала сперматогенного эпителия, при адекватной гормонотерапии и обязательном динамическом наблюдении функции яичек — у части пациентов возможно получить увеличение количества сперматозоидов. Улучшение количественных параметров спермограммы при этом наблюдается лишь в 20-25% случаев, отсутствие положительных сдвигов нередко наблюдается при олигозооспермии III-IV степени. Консервативное лечение при первичном гипогонадизме должно проводиться 2-3-х месячными курсами с интервалами, не более года.
Вторичный гипогонадизм встречается намного реже первичного и отдельные его формы, как врождённые (врождённый пангипопитуитаризм, гипофизарный нанизм), так и приобретённые, клинически протекают с такой тяжёлой общесоматической и неврологической симптоматикой, что пациенты менее всего озабочены проблемой возможного бесплодия. Заместительная терапия гонадотропными гормонами является патогенетической и, нередко, дает определенные положительные изменения в спермограмме в большинстве случаев.
Низкая эффективность консервативного лечения секреторного мужского бесплодия объясняется изолированностью, замкнутостью половых желез, как автономной саморегулирующейся системы. Окончательное формирование половых желез, их созревание и функционирование достигается к 16-18 годам. Именно поэтому фармакологическое или иное вмешательство в эту систему у взрослого мужчины (проводимое даже под скрупулезным клинико-лабораторным контролем) зачастую не даёт положительных результатов. Воздействию извне препятствует наличие гематотестикулярного барьера в яичках, который завершает своё развитие к 13-14 годам и полностью изолирует сперматоциты от внешних неблагоприятных влияний. До формирования гематестикулярного барьера, то есть до 13-14 лет — сперматогенный эпителий беззащитен и чувствителен к любому вредному внешнему воздействию и способен дегенерировать. Это и является причиной возникновения необратимых патоморфологических изменений в яичках при воздействии вредных влияний в эмбриогенезе или допубертатном периоде.
Этим объясняется и низкая эффективность консервативного лечения секреторного бесплодия у взрослого. Таким образом, возрастает необходимость своевременной его профилактики в детском возрасте (препубертатном возрасте).
Экскреторно-токсическая
Наиболее перспективной формой для лечения является экскреторно-токсическое и смешанная формы мужского бесплодия в начальных фазах развития, когда нарушается в основном подвижность и морфология сперматозоидов, и нередко имеются клинико-лабораторные признаки воспалительного фона в предстательной и других придаточных железах. Эффективность консервативных методов лечения варьируется от 50 до 70% клинических случаев. При многолетнем вялотекущем воспалении простаты (и/или семенных пузырьков), значительно ухудшающим морфологию и подвижность сперматозоидов подключается спровоцированная патологией простаты гипоандрогения, ведущая к постепенному нарастанию олигозооспермии, вплоть до самых тяжелых количественных изменений. Гонадостатная система яички-простата-семенные пузырьки функционируют единым физиологическим механизмом и при функциональных нарушениях одного из звеньев — последовательно начинает угнетаться функциональная активность и других органов. Таким образом, при длительной или нелеченной патологии придаточных половых желез, обеспечивающих оплодотворяющую способность эякулята — с течением времени в яичках снижается синтез, освоение и нормальный метаболизм мужского полового гормона.
Основополагающими принципами лечения инфекционно-токсической (экскреторное) формы бесплодия является последовательная этапность терапии:
- 1 этап — комплексное противовоспалительное лечение, включающее этиопатогенетическую и специфическую терапию, направленную на восстановление трофики и полноценного функционирования придаточных половых желез.
- 2 этап — стимуляция подвижности сперматозоидов с помощью витаминов, незаменимых аминокислот, биостимуляторов, ферментов, улучшающих обменно-энергетические процессы в половых железах. При наличии гипоандрогении — не исключено проведение курса стимуляции гонадотропинами с целью коррекции.
- 3 этап — с учетом широкого распространения в настоящее время урогенитальных вирусных инфекций, таких как цитомегаловирусная инфекция, вирус простого герпеса I и II типа — необходимо проведение адекватного противовирусного курса. Эти вирусные инфекции способны передаваться половым путем. В спермиологии есть термин — вирусное инфицирование сперматозоидов. Влияние мочеполовых вирусов на оплодотворяющую способность спермы до сих пор дискутируется, однако, надо заметить, что ЦМВ и ВПГ I и II типа способны пожизненно персистировать в ткани яичка, и окончательно их роль с точки зрения возможных репродуктологических проблем не выяснена до сих пор.
Сочетанное (секреторная + экскреторно-токсический вариант) или смешанное
Почти в 30-40% случаев мужского бесплодия имеет место сочетанное (смешанная форма) бесплодие, при котором патогенез гипогонадизации и патоспермии обусловлен морфологическими изменениями яичек (врождённого или приобретённого генеза), а с другой стороны — следствием длительнотекущего воспаления придаточных половых желез (приобретённый метаболический гипогонадизм).
В случае, если в клинической картине сочетанного бесплодия преобладают секреторные нарушения, то наряду с комплексной противовоспалительной терапией назначается стимуляция сперматогенеза (витамин Е, биостимуляторы, в дальнейшем гормонотерапия). В тех случаях сочетанного бесплодия где преобладает инфекционно-токсический (экскреторный) компонент — гормонотерапия целесообразна (при необходимости) лишь после проведения адекватной комплексной противовоспалительной терапии.
Гормонотерапия может использоваться только с целью коррекции уже имеющейся доказанной андрогенной недостаточности или для поддержания сексуальной функции в случае её нарушения. Семейная пара, состоящая в таком бесплодном браке, обязательно нуждается в психотерапевтической подготовке к искусственному оплодотворению супруги (при наличии способности к зачатию) спермой донора. При абсолютной неспособности супруги к зачатию следует рекомендовать усыновление ребёнка.
ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫЕ ЗАБОЛЕВАНИЯ ОРГАНОВ МАЛОГО ТАЗА В МУЖСКОМ БЕСПЛОДИИ
Адекватное лечение хронических воспалительных заболеваний мочеполового тракта у мужчин всегда было достаточно непростой и сложной задачей в консервативной урологии и андрологии. В последнее десятилетие наблюдается рост воспалительных заболеваний органов малого таза (уретрит, простатит, везикулит, простатовезикулит, фуникулит, эпидидимит), которые, согласно статистическим данным, являются наиболее частой причиной мужского фактора бесплодия. Если учитывать относительно небольшое количество встречающихся у мужчин истинно секреторных (врожденных) форм мужского бесплодия по отношению к приобретенным нарушениям фертильности в виде олиго- и патоспермии, то становится ясно, что главенствующую роль в снижении репродуктивного потенциала мужчин играют приобретенные хронические воспалительные заболевания малого таза. Необходимо добавить, что внешние факторы среды (экология, курение и т.д.) как серьезные причины воспалительных заболеваний малого таза несостоятельны и в исключительных случаях способны повлиять на фертильность.
Хронический вялотекущий воспалительный процесс в половых органах способствует нарушению в них кровообращения и в последующем, нарушению их функции. В дальнейшем, в течении нескольких лет реализуется каскад патофизиологических механизмов, приводящих к нарушению синтеза и освоения тестостерона и эстрогенов, дискоординации нейроэндокринных механизмов саморегуляции придаточных половых желез, прогрессированию аутоиммунных процессов и фибросклеротических изменений в тканях, нарушению процессов синтеза ряда биологически активных веществ , что в постепенном итоге приводит к:
- разнобразным формам нарушения оплодотворяющей способности сперматозоидов, например, к нарушению капацитации и акросомальной реакции. Даже при нормозооспермии, но при наличии признаков воспаления в спермограмме мужчину нельзя считать полностью фертильным.
- возникновению патоспермии, которая наблюдается у большинства пациентов.
- нарушению физико-химических свойств семенной жидкости: изменяется рН, снижается активность протеолитических ферментов, отвечающих за разжижение спермы, уменьшается концентрация лимонной кислоты, фруктозы, лизоцима, ионов цинка.
- наличие микрофлоры и бактериальных токсинов в секретах половых желез (с последующим попаданием их в сперму), приводит к агглютинации сперматозоидов.
- поражению гематотестикулярного барьера и развитию антиспермального иммунитета.
В настоящее время при определении этиологического фактора воспалительной патологии урогенитального тракта акцент делается на выявление инфекций, передающихся половым путем (бактерии, вирусы). Надо заметить, что в результате повсеместного и бесконтрольного применения антибиотиков, в том числе и в пищевых продуктах – микроорганизмы значительно сумели видоизмениться и эволюционировать в условиях мочеполовой системы макроорганизма, и зачастую, современные и чувствительные методики выявления персистирующих ИППП не дают желаемого результата в виде лабораторной идентификации возбудителя.
Существует, однако и ряд других, не менее важных, этиологических факторов в патогенезе воспалительных заболеваний малого таза, приводящих к снижению репродуктивной функции.
Инфекционный воспалительный процесс в урогенитальном тракте возникает по двум механизмам
- В первом случае патогенная ИППП вызывает клинически и лабораторно выявляемый острый уретрит, который в дальнейшем приводит к возникновению восходящего воспалительного процесса. Этиопатогенетическая роль инфекции в данном случае бесспорна: при исследовании уретрального отделяемого, секрета предстательной железы, семенной жидкости выявляется лейкоцитоз и наличие ИППП; первично воспалительный процесс начинается с клинической картины уретрита.
- Второй механизм более сложный. Возникновению инфекционного воспалительного процесса в урогенитальном тракте предшествуют определенные предрасполагающие факторы.
Выделим несколько основных групп:
- К первой группе факторов относятся сосудистые и морфофункциональные изменения в тазовых органах, которые возникают вследствие застойных явлений в органах малого таза, нерегулярной половой жизни.
- Инфравезикальная обструкция также является предрасполагающей причиной инфекционного воспаления. Возникает ретроградный ток мочи в протоки и ацинусы предстательной железы во время мочеиспускания вследствие повышения внутриуретрального давления. Это может привести к инфицированию предстательной железы микрофлорой из вышележащих мочевых путей.
- Важнейшей предрасполагающей причиной воспалительного процесса урогенитального тракта является вторичный иммунодефицит, который развивается на фоне вялотекущей бактериальной внутриклеточной инфекции (хламидии, микоплазмы, уреаплазмы) и вирусной инфекции ( генитальный герпес, цитомегаловирус ). Инфицирование урогенитального тракта данными инфекциями приводит к характерному нарушению фагоцитарной активности, снижению иммуноглобулинов класса А, увеличении иммуноглобулинов класса G; нарушению Т хелперного взаимодействия, а также определенные морфофункциональные изменения в тазовых органах открывают путь к инфицированию урогенитального тракта условно-патогенной бактериальной микрофлорой.
При развитии инфекционного процесса в мочеполовом тракте по данному механизму отсутствует какая-либо клиническая картина уретрита, в соскобах из уретры будет значимо реже выявляться ИППП, однако у пациентов будет присутствовать клинически и лабораторно верифицируемый воспалительный процесс в простато-везикулярном комплексе или в органах мошонки.
При наличии вышеуказанных предрасполагающих факторов инфицирование урогенитального тракта условно-патогенной и банальной бактериальной микрофлорой принципиально возможно двумя путями: уретральным и гематогенным.
Гематогенным путем инфицирование чаще всего происходит из очагов ЛОР-патологии, при заболеваниях прямой кишки с хроническими запорами, геморрое. Инфицирование по данному пути чаще всего происходит тогда, когда в половых органах уже имеются значимые структурные изменения ( конгестия, кальцинаты, ДГПЖ ).
Более значим трансуретральный путь инфицирования вторичной бактериальной микрофлорой.
Следует выделить 2 основных источника бактериального инфицирования.
- Широкое распространение бактериального вагиноза у женщин. Зачастую, у женщин, обследованных по поводу воспалительных заболеваний половых органов, в 25% случаев выявляется бактериальный вагиноз. Причиной бактериального вагиноза является мелкая условно-патогенная палочковая флора, которая нередко приводит к инфицированию урогенитального тракта мужчин. Причиной бактериального вагиноза являются вялотекущие бактериальные и персистирующие вирусные инфекции, гормональные нарушения и другие причины, вызывающие вторичный иммунодефицит.

- 2. Распространенность оральногенитальных и анальных половых сношений также является источником инфицирования урогенитального тракта мужчин. В первом случае инфицирование происходит преимущественно стрептококковой или стафилококковой микрофлорой, во втором случае — Гр- палочковой флорой (протей, клебсиелла, кишечная палочка и т.д.)

Лечение этих заболеваний будет только в том случае успешным и окончательным, если реализуется комплексный подход, который базируется на знании этиопатогенетических механизмов воспаления, иммунореактивности на данный воспалительный процесс и функциональных изменениях в половых органах.
Акопян Нерсес Григорьевич.
Уролог, андролог, сексопатолог, кандидат медицинских наук.
Мужское бесплодие — симптомы и лечение
Что такое мужское бесплодие? Причины возникновения, диагностику и методы лечения разберем в статье доктора Рыжкова Алексея Игоревича, уролога со стажем в 16 лет.
Над статьей доктора Рыжкова Алексея Игоревича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Под бесплодием понимают отсутствие зачатия в паре, живущей регулярной половой жизнью без использования контрацепции на протяжении более одного года. [1] С бесплодием ежегодно сталкиваются примерно 15% пар, планирующих зачатие. [2]
Причиной бесплодия могут быть нарушения репродуктивной функции у одного из партнёров (мужчины или женщины) или у обоих партнёров. Последнее наблюдается наиболее часто, так как нарушенная фертильность (способность иметь детей) одного из партнёров может компенсироваться сохранной фертильностью другого. [1]
О мужском факторе, или мужском бесплодии (Male infertility), говорят при наличии у мужчины изменений параметров спермы или механизма её доставки, препятствующих зачатию. Такая ситуация наблюдается у половины мужчин, обследованных по поводу бесплодия в браке. Причины мужского бесплодия достаточно многообразны и включают в себя медицинские факторы:
- — это варикозное расширение вен мошонки, нарушающее кровоснабжение яичка. Самая распространенная обратимая причина мужского бесплодия. Точная причина, по которой варикоцеле вызывает бесплодие, неизвестна, вероятно, это связано с повышением температуры мошонки, приводящим к нарушению сперматогенеза и снижению качества спермы. Лечение варикоцеле позволяет улучшить параметры спермы, повысить шансы на естественное зачатие и зачатие в результате применения вспомогательных репродуктивных методов (ЭКО/ИКСИ).
- Инфекции репродуктивной системы, которые сопровождаются попаданием в сперму различных продуктов воспаления, нарушающих функционирование сперматозоидов, что приводит к ухудшению параметров спермы. К ним относятся: воспаление придатка яичка (эпидидимит) или самого яичка (орхит), предстательной железы (простатит) и некоторые инфекции, передающиеся половым путём, включая хламидийную инфекцию, гонорею, трихомониаз.
- Нарушения эякуляции. Чаще всего к бесплодию приводит ретроградная эякуляция — состояние, когда сперма во время оргазма не выходит через мочеиспускательный канал наружу, а движется в противоположную сторону и попадает в мочевой пузырь. К ретроградной эякуляции может приводить сахарный диабет, травмы позвоночника, приём некоторых лекарственных препаратов, а также операции на предстательной железе или мочевом пузыре. Гораздо реже встречается задержка эякуляции, когда мужчина во время полового акта не может достичь оргазма или достигает, но не во всех половых актах, и ему на это требуется значительное количество времени (иногда более часа).
- Иммунные факторы. Сперматозоиды, в отличие от остальных клеток организма, содержат половинный набор хромосом, поэтому иммунная система воспринимает их как чужеродные клетки. При контакте со сперматозоидами иммунная система вырабатывает специальные белки — антитела, которые фиксируются к сперматозоидам и нарушают их функционирование. В норме этого не происходит, так как яички устроены особым образом, и сперматозоиды в процессе созревания ограждены от взаимодействия с клетками иммунной системы специальной структурой — гематотестикулярным барьером. Но любое нарушение структуры яичка (травма, варикоцеле, нарушение проходимости семявыносящих путей) может приводить к повреждению гематотестикулярного барьера и образованию антиспермальных антител.
- Неопущенне яичек (крипторхизм). У некоторых мужчин одно или оба яичка при рождении не опущены в мошонку, а находятся в паховой области или брюшной полости. Вне мошонки яички не могут полноценно функционировать, так как для сперматогенеза необходима температура ниже температуры тела. Это приводит к необратимому нарушению сперматогенеза, которое сохраняется даже после хирургического опущения яичек в мошонку. Вероятность бесплодия значительно выше у мужчин с двусторонним крипторхизмом, чем с односторонним.
- Гормональные расстройства. Заболевания щитовидной железы (гипер- и гипотиреоз), заболевания надпочечников, низкий уровень тестостерона (мужской гипогонадизм) негативно влияют на сперматогенез. Самые тяжёлые нарушения сперматогенеза наблюдаются при дефиците основного гормона, стимулирующего сперматогенез — ФСГ (фолликулостимулирующий гормон), но такие состояния наблюдаются редко.
- Опухоли. Доброкачественные и злокачественные опухоли самого яичка и структур, регулирующих сперматогенез, например, гипофиза или гипоталамуса, часто сопровождаются тяжелыми нарушениями выработки сперматозоидов. Негативным образом на качестве спермы сказываются и методы, применяемые для лечения опухолей: химиотерапия, лучевая терапия, хирургическое вмешательство.
- Непроходимость семявыносящих путей. Семявыносящие пути, по которым движутся сперматозоиды, могут быть заблокированы на разном уровне: внутри яичка, в придатке яичка, семявыносящем протоке, на уровне предстательной железы или в уретре. Причины включают в себя повреждение во время операции (например, по поводу паховой грыжи), перенесённые инфекции, травмы или неправильное развитие в результате наследственных заболеваний.
- Хромосомные дефекты. Врожденные заболевания, например, синдром Клайнфелтера, при котором мужчины рождаются с двумя Х-хромосомами и одной Y-хромосомой (вместо одной Х и одной Y), приводят к неправильному развитию мужских репродуктивных органов. Другие генетические синдромы, связанные с бесплодием, включают муковисцидоз, синдром Кальмана и синдром Картагенера.
- Сексуальные проблемы. Они могут включать в себя проблемы с сохранением или поддержанием эрекции, достаточной для проведения полового акта (эректильная дисфункция), преждевременной эякуляцией, болезненным половым актом, анатомическими аномалиями (расположение наружного отверстия мочеиспускательного канала на нижней поверхности полового члена (гипоспадия), или психологические проблемы и проблемы межличностных отношений, препятствующие полноценной регулярной половой жизни.
- Приём лекарственных препаратов. Заместительная терапия тестостероном, длительное использование анаболических стероидов, лекарственные препараты для лечения рака (химиотерапия), противогрибковые препараты, препараты, используемые для лечения язвенной болезни, и некоторые другие лекарства могут снижать качество спермы.
- Перенесённые операции. Некоторые операции могут препятствовать попаданию сперматозоидов в эякулят. Это вазэктомия (пересечение семявыносящих протоков с целью контрацепции), операции по поводу паховой грыжи, операции на мошонке или яичках, операции на простате и большие операции на брюшной полости, проводимые при раке яичка и прямой кишки.
Причиной мужского бесплодия могут стать факторы внешней среды, такие как:
- Промышленные химикаты. Длительное воздействие бензола, толуола, ксилола, пестицидов, гербицидов, органических растворителей, малярных материалов и свинца негативно сказывается на качестве и количестве спермы.
- Тяжёлые металлы. Воздействие свинца или других тяжёлых металлов также может угнетать сперматогенез.
- Радиация или рентгеновское излучение. Воздействие радиации может значительно снизить количество сперматозоидов в сперме. Как правило, эффект обратимый, и через некоторое время параметры спермы восстанавливаются до нормальных значений. При высоких дозах облучения производство спермы может быть нарушено необратимо.
- Перегрев яичек. Повышение температуры мошонки негативно сказывается на сперматогенезе. Частое использование саун, бань может ухудшить качество спермы. Длительное пребывание в сидячем положении, тесное белье и одежда, работа с ноутбуком, лежащим на коленях, также может повысить температуру мошонки и негативно повлиять на производство спермы.
Образ жизни, вредные привычки и условия профессиональной деятельности также влияют на мужскую фертильность:
- Употребление наркотиков. Кокаин и марихуана обладают обратимым негативным эффектом на количественные и качественные параметры спермы.
- Чрезмерное употребление алкоголя. Злоупотребление алкоголем может снизить уровень тестостерона, вызвать эректильную дисфункцию и уменьшить производство спермы. Заболевания печени, вызванные чрезмерным употреблением алкоголя, также приводят к проблемам с фертильностью.
- Курение табака. У мужчин, которые курят, качество спермы существенно хуже, чем у некурящих мужчин. Пассивное курение тоже может влиять на мужскую фертильность.
- Эмоциональный стресс. Вырабатываемые во время стресса гормоны подавляют секрецию веществ, стимулирующих сперматогенез. Длительный и сильный стресс может приводить к существенным изменениям параметров спермы.
- Избыточный вес.Ожирение вносит дисбаланс в нормальный мужской гормональный статус, что приводит к снижению мужской фертильности.
- Профессиональная вредность. Мужчины некоторых профессий, например, водители или сварщики, имеют больший риск бесплодия по отношению к остальным мужчинам. [3]
У 30% мужчин с нарушением параметров спермы установить причину не удаётся, такую форму мужского бесплодия называют идиопатической (беспричинной).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Патогенез мужского бесплодия
Процесс создания сперматозоидов (сперматогенез) происходит в яичке. 90-95% объёма яичек представлено специальными трубочками — семенными канальцами, в которых происходит процесс создания сперматозоидов — сперматогенез. Процесс создания одного сперматозоида занимает около 70 дней.
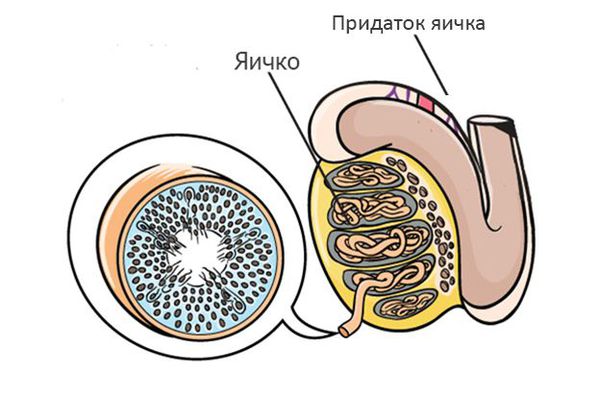
Процесс создания сперматозоидов стимулируется фолликулостимулирующим гормоном (ФСГ), который вырабатывается в участке головного мозга — гипофизе. При отсутствии ФСГ сперматогенез не протекает, и сперматозоиды не образуются.
Сперматогенез — процесс достаточно деликатный. Множество факторов могут нарушать его нормальное течение (повышение температуры мошонки, приём лекарственных препаратов, рентгеновское излучение) и привести к созданию сперматозоидов с неправильной структурой (морфологией), слабой подвижностью и дефектным генетическим материалом, не способных к оплодотворению.
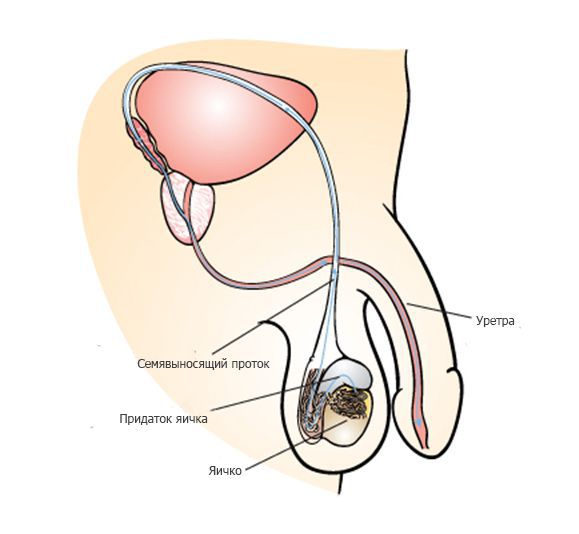
После выхода из яичка сперматозоиды попадают в длинную извилистую трубку, которая называется придаток яичка. В результате прохождения придатка яичка, которое занимает около недели, сперматозоиды улучшают свою подвижность, а также происходит изменение молекул на поверхности сперматозоида, необходимое для взаимодействия с яйцеклеткой.
На фоне воспалительных процессов в придатке яичка процесс созревания сперматозоидов может нарушаться, и они не смогут оплодотворить яйцеклетку. В отдельных случаях, в результате воспалительного процесса или после операций на придатке формируется препятствие прохождению сперматозоидов, в результате чего они не попадают в сперму.
После прохождения придатка яичка сперматозоиды могут храниться в теле мужчины на протяжении нескольких недель, сохраняя способность к оплодотворению. Но если сперма хранится слишком долго, сперматозоиды начинают деградировать и погибать.
Разрушающаяся сперма может повредить новые сперматозоиды, не давая им возможности покинуть придаток яичка. Мужчинам рекомендуется эякулировать каждые два или три дня, чтобы поддерживать качество спермы в оптимальном состоянии.
Во время эякуляции около 250 миллионов сперматозоидов начинают движение через семявыносящий проток и мочеиспускательный канал (уретру) наружу. Движение сперматозоидов обеспечивается сокращением мышц семявыносящего протока и уретры, которые сопровождаются приятными оргастическими ощущениями. Как правило, выброс спермы происходит в несколько порций. Большинство сперматозоидов содержатся в первой порции, во второй и третьей содержится преимущественно секрет дополнительных мужских половых желез — предстательной железы и семенных пузырьков.
Секрет добавочных половых желез (простаты и семенных пузырьков) необходим для обеспечения жизнедеятельности сперматозоидов после эякуляции. При воспалительном или ином патологическом процессе в простате или семенных пузырьках состав их секрета может изменяться, что нарушает функционирование сперматозоидов и снижает вероятность зачатия.
После попадания во влагалище сперматозоиды должны в течение нескольких минут его покинуть и переместиться в шейку матки. Дело в том, что среда влагалища является кислой, что необходимо для защиты женского организма от попадания бактерий и вирусов. Однако кислая среда быстро разрушает сперматозоиды, если сперматозоид находится в ней больше двух минут, он погибает. По статистике, лишь одному из 100 сперматозоидов удается покинуть влагалище и переместиться в шейку матки.
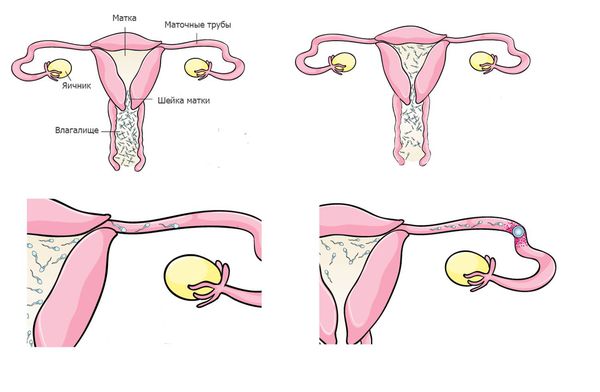
В связи с этим очень важно, чтобы сперматозоиды во время эякуляции попадали максимально близко к шейке матки, что невозможно при таких аномалиях, как гипоспадия (наружное отверстие уретры находится на нижней поверхности полового члена).
Шейка матки содержит специальную слизь, которая, с одной стороны, защищает сперматозоиды от агрессивной среды влагалища, с другой — может препятствовать их дальнейшему движению. Консистенция слизи зависит от гормонального статуса женщины, и большую часть времени она не проницаема даже для самых здоровых и подвижных сперматозоидов. За несколько дней до овуляции консистенция слизи меняется таким образом, что она становится способной пропустить сперматозоиды.
В отдельных случаях в слизи шейки матки могут содержаться антитела (белки, вырабатываемые иммунной системой для борьбы с чужеродными субстанциями, попавшими в организм) к сперматозоидам, которые не позволяют сперматозоидам пройти цервикальную слизь даже во время овуляции.
После прохождения шейки матки сперматозоид попадает в матку, и перед ним возникает дилемма — в какую маточную трубу двигаться дальше: правую или левую. Женщины имеют две маточные трубы (по одной с каждой стороны), но только в одну из них каждый месяц из яичника выходит яйцеклетка. В этой ситуации организм женщины приходит на помощь сперматозоиду. В период, близкий к овуляции, за счет гормональных воздействий мышцы матки на стороне овуляции начинают ритмично сокращаться, указывая сперматозоиду на правильное отверстие маточной трубы.
Следующий для сперматозоида этап — прохождение отверстия маточной трубы. Оно очень маленькое, диаметром лишь несколько головок сперматозоида, поэтому сперматозоиды, которые движутся хаотично, не смогут в него войти. Этот этап преодолевают только сперматозоиды с быстрым и прямолинейным движением.
Попав в маточную трубу, сперматозоиды оказываются в достаточно благоприятной среде, прикрепляются к стенкам трубы и ждут выхода яйцеклетки. В таком состоянии они могут находиться достаточно долго — около 48 часов.
Выход яйцелетки из яичника сопровождается повышением температуры в маточной трубе на 1-2 градуса, что служит сигналом для гиперактивации сперматозоидов. Они начинают интенсивные движения хвостом, открепляются от стенки и быстро движутся навстречу яйцеклетке. На этом этапе остаётся 6-8 сперматозоидов, и у них есть несколько часов, чтобы оплодотворить яйцеклетку, так как срок её жизни очень короток.
По сравнению со сперматозоидом, яйцеклетка — довольно большая клетка, самая крупная в человеческом теле. После выхода из яичника она окружена облаком клеток, называемых фолликулярными, через которые сперматозоиды должны проникнуть прежде, чем вступить в контакт с поверхностью яйцеклетки. Чтобы пройти через фолликулярные клетки, сперматозоиды должны использовать интенсивный стиль движения (гиперактивация), который они использовали, чтобы отделиться от стенок маточной трубы.
После прохождения фолликулярных клеток до яйцеклетки добирается 1–2 сперматозоида, которым необходимо попасть внутрь. Для этого у сперматозоида есть мешочек ферментов на самом верху головки, который лопается, как только сперматозоид вступает в контакт с внешней поверхностью яйцеклетки. Эти ферменты помогают растворить внешнюю мембрану яйцеклетки и в сочетании с мощными движениями хвоста помогают сперматозоиду проникнуть внутрь яйцеклетки. Как только сперматозоид попадает внутрь, мембрана яйцеклетки меняет свои химические свойства и становится полностью непроницаемой для остальных сперматозоидов. После слияния сперматозоида с яйцеклеткой образуется эмбрион, и начинается развитие беременности.
Если сперматозоид функционально незрелый и не содержит на своей поверхности необходимые сигнальные молекулы, он не сможет вступить в контакт с яйцеклеткой, и оплодотворение не произойдёт. Существует редкая аномалия — глобулозооспермия, когда сперматозоиды имеют не коническую, а круглую головку. Причиной этого является отсутствие мешочка с ферментами (акросомы), что также исключает проникновение сперматозоида внутрь яйцеклетки.
Классификация и стадии развития мужского бесплодия
- Первичное — женщине/женщинам ни разу не удавалось забеременеть от данного мужчины.
- Вторичное — ранее были беременности, но на настоящий момент после года регулярной половой жизни без контрацепции зачатие не происходит.
Диагностика мужского бесплодия
Диагностика мужского бесплодия включает в себя следующие обязательные методы:
- Осмотр и с сбор анамнеза (истории заболевания). Врач проводит осмотр и пальпацию (прощупывание) органов репродуктивной системы, что позволяет диагностировать такие состояния, как варикоцеле, крипторхизм, аномалии развития мужских половых органов. С помощью опроса выявляют наличие у пациента наследственных состояний, хронических заболеваний, перенесённых травм и операций, особенности сексуальной жизни, которые могут повлиять на вероятность зачатия.
- Анализ спермы (спермограмма). Сперму для исследования мужчина сдаёт посредством мастурбации. Исследование требует от мужчины определенных ограничений — исключить тяжёлые физические нагрузки, употребление алкоголя, а также половое воздержание на протяжении 3-4 дней до исследования.
После сдачи образца сперма исследуется в лаборатории, оценивается общее количество сперматозоидов, количество сперматозоидов с неправильной формой (морфологией), а также скорость и характер движения сперматозоидов. Анализ спермы достаточно сложен, выполняется вручную и зависит от квалификации выполняющего его специалиста. Рекомендуется выполнять анализ спермы в специализированных лабораториях, расположенных при центрах лечения бесплодия.
Если анализ спермы не выявляет отклонений от нормы, то перед дальнейшим углубленным обследованием мужчины следует провести тщательное обследование женщины для исключения у неё факторов, препятствующих наступлению беременности.
При выявлении отклонений от нормы дальнейший план обследования составляется индивидуально в зависимости от результатов предыдущих исследований и может включать в себя следующие методы:
- Ультразвуковое исследование мошонки. Этот тест позволяет выявить варикоцеле, изменения структуры придатка и яичка, указывающие на наличие воспалительного процесса или нарушение проходимости семявыносящих путей.
- Допплерография сосудов мошонки — метод оценки кровотока по сосудам яичка, наиболее точный метод диагностики варикоцеле.
- Трансректальное ультразвуковое исследование — позволяет оценить структуру предстательной железы, что важно при диагностике инфекций добавочных мужских желез и обструкции семявыносящих путей.
- Мазки из уретры на урогенитальную инфекцию. Некоторые урогенитальные инфекции, например, хламидии, могут протекать скрыто, но при этом оказывать негативное влияние на параметры спермы.
- Бактериологическое исследование спермы. Исследование позволяет выявить наличие в сперме бактериальной инфекции. Обязательный метод исследования при подозрении на инфекцию добавочных мужских половых желез.
- Определение уровня гормонов крови. Используется при низком количестве сперматозоидов. Оценивают гормоны, влияющие на сперматогенез: фолликулостимулирующий гормон, лютеинизирующий гормон, тестостерон, эстрадиол. По особым показаниям определяют гормоны щитовидной железы и надпочечников.
- Генетические тесты. Обязательное исследование при отсутствии сперматозоидов в сперме или их крайне низкой концентрации. Исследование может включать анализ на делеции в Y-хромосоме (отсутствие определённых участков в Y-хромосоме), оценку кариотипа (количества хромосом), оценку мутаций в гене, ответственном за муковисцидоз (CFTR).
- Биохимическое исследование спермы. Позволяет оценить концентрацию в сперме веществ, секретируемых той или иной железой. Для придатка яичка это альфа-гликозидаза, для семенных пузырьков — фруктоза, для простаты — цинк и лимонная кислота. Отсутствие одного или нескольких этих веществ позволяет подтвердить диагноз обструкции семявыносящих путей и заподозрить её уровень.
- Биопсия яичек. Используется для оценки сохранности сперматогенеза в яичке при отсутствии сперматозоидов в сперме. В случае получения сперматозоидов в результате биопсии они должны быть подвергнуты криоконсервации, чтобы избежать повторных операций. Методики биопсии рассмотрены ниже.
- Оценка ДНК-фрагментации сперматозоидов. Метод позволяет оценить количество сперматозоидов, содержащих повреждённый генетический материал (ДНК с разрывами). Использование данного метода показано при потере беременности (выкидыш, замершая беременность) на ранних сроках, а также при отсутствии зачатия на фоне нормальных показателей спермограммы.
- HBA-тест. Тест позволяет оценить функциональную зрелость сперматозоидов по возможности связываться с гиалуроновой кислотой. Гиалуроновая кислота имитирует поверхность яйцеклетки, если сперматозоид не связывается с гиалуроновой кислотой, то он не сможет взаимодействовать с яйцеклеткой.
Лечение мужского бесплодия
Тактика лечения мужского бесплодия зависит от причины, его вызвавшей.
Хирургическое лечение
- Варикоцеле — устранение этой причины мужского бесплодия возможно только посредством оперативного лечения. Наилучшие результаты в отношении частоты наступления беременности и уровня послеоперационных осложнений показывает микрохирургическая субингвинальная варикоцелэктомия. [4]
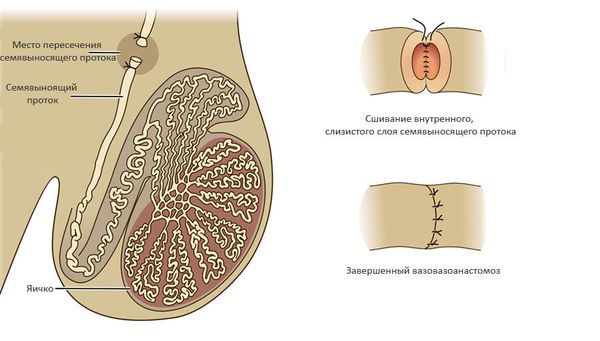
- Обструкция семявыносящих путей — в ряде случаев нарушенную проходимость семявыносящих путей можно восстановить хирургическим путем. Наилучшие результаты имеют операции: вазовазоаностомоз (соединяют между собой концы пересечённого семявыносящего протока).
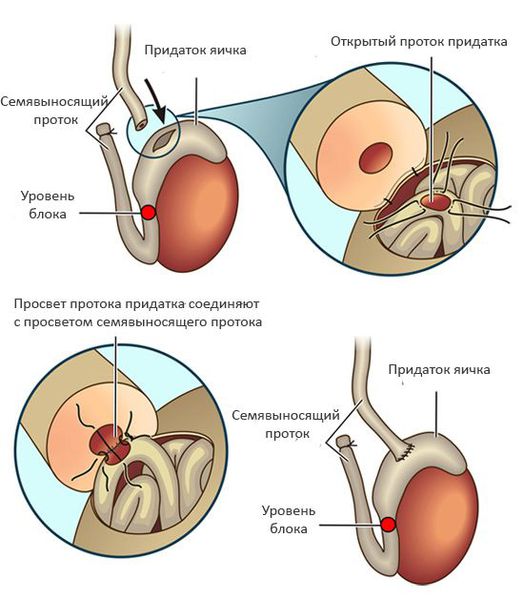
При обструкции на уровне придатка яичка используют вазоэпидидимоанастомоз (соединение семявыносящего протока с протоком придатка яичка). Эффективность данного подхода составляет 60-87% и во многом зависит от опыта хирурга и времени, прошедшего с момента формирования обструкции. [5]
- Биопсия яичка — хирургическое извлечение сперматозоидов из яичка и придатка. Данный подход преимущественно используется при обструктивной и необструктивной азооспермии для получения сперматозоидов с целью их последующего использования в процедуре ЭКО/ИКСИ. Применяют следующие методы биопсии яичка:
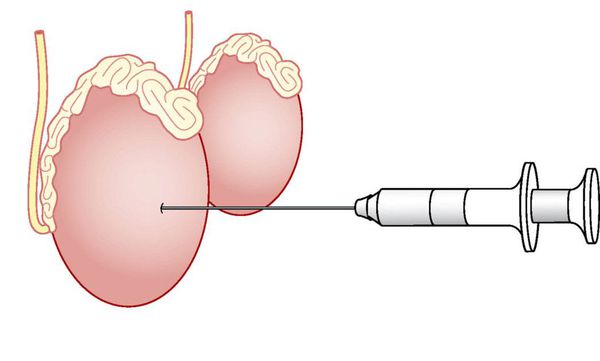
Тонкоигольная биопсия яичка (TESA)
Через кожу в ткань яичка проводят тонкую иглу и выполняют аспирацию (всасывание) тестикулярной ткани, из которой в последующем извлекают сперматозоиды. Преимущество данной методики — в малой травматичности для пациента. Недостаток — низкая вероятность обнаружения сперматозоидов при необструктивной азооспермии (20-30%), что делает данную методику оправданной только при доказанной обструктивной азооспермии, когда вероятность наличия сперматозоидов приближается к 100%. [6]
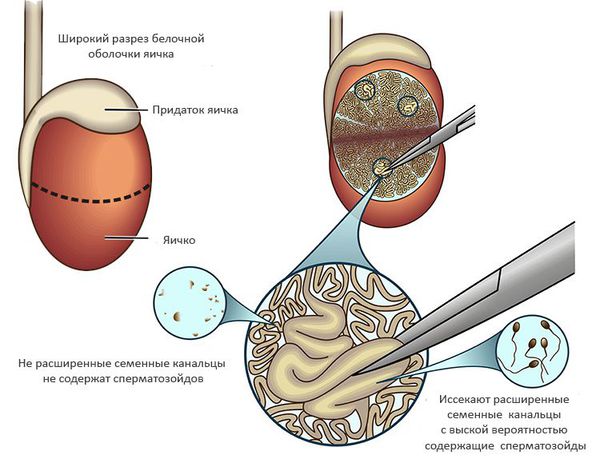
Открытая биопсия яичка (TESE)
Производится небольшой разрез кожи мошонки — 1,5-2 см, выделяется яичко, рассекается его оболочка на небольшом протяжении. Из полученного отверстия забирается небольшой фрагмент ткани, разрезы зашивают, а полученный материал исследуют на наличие сперматозоидов. Средняя вероятность обнаружения сперматозоидов при необструктивной азооспермии для TESE составляет 40-50%. [6]
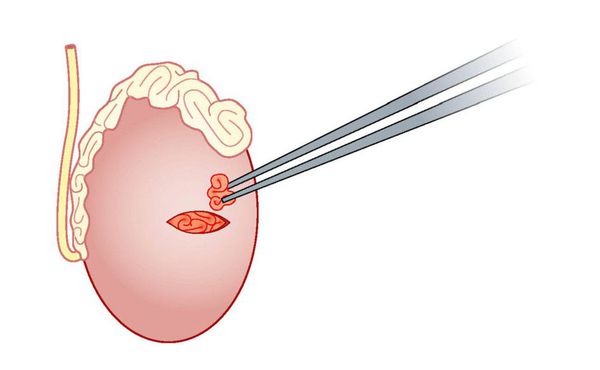
Микрохирургическая биопсия яичек (microTESE)
Методика отличается от TESE использованием операционного микроскопа с 15-20-кратным увеличением, что требует большего разреза на яичке, но позволят детально исследовать его ткань для обнаружения и извлечения расширенных семенных канальцев, которые наиболее вероятно содержат сперматозоиды. Представленный подход значительно повышает шансы на обнаружение сперматозоидов по сравнению с методиками случайной биопсии (TESA, TESE). Средняя вероятность получения сперматозоидов при необcтруктивной азооспермии для microTESE составляет 60-70%. [4]
Лекарственная терапия имеет несколько направлений:
- Антибактериальные препараты применяются у пациентов с инфекцией добавочных мужских половых желез.
- Препараты для коррекции сексуальной дисфункции используются при наличии у пациента эректильный дисфункции или преждевременной эякуляции.
- Гормональная терапия применяется, если причиной бесплодия являются нарушения уровня половых гормонов: низкий уровень ФСГ, тестостерона или высокий уровень пролактина.
- Антиоксидантная терапия используется в том числе при идиопатическом мужском бесплодии, так как оксидативый — наиболее частый фактор, приводящий к нарушению качества спермы.
Коррекция образа жизни — основной подход в коррекции идиопатического мужского бесплодия и важное дополнение в лечении установленной причины нарушения фертильности. Пациент получает индивидуальные рекомендации, исходя из особенностей его жизни:
- нормализация режима труда и отдыха (8 часов сна), избегать стрессовых ситуаций;
- увеличить количество в рационе продуктов, содержащих полиненасыщенные жирные кислоты (морская рыба, морепродукты);
- минимизировать потребление жареной пищи;
- потребление кофеина не более 100 мг/сутки (1 чашка кофе); [7]
- исключить потребление колы;
- минимизировать потребление алкоголя, [8] не более 5 единиц (1 единица — 10 грамм чистого спирта) в неделю;
- исключить курение/снизить количество сигарет, потребляемых в сутки; [9]
- повысить физическую активность (пробежки, умеренные физические нагрузки);
- исключить факторы, нагревающие мошонку (горячие ванны, сауны, бани, работа с ноутбуком, лежащим на коленях, не носить облегающее нижнее белье);
- регулярная половая жизнь — через 1-2 дня (3 раза в неделю), не использовать лубриканты (смазки), содержащие спермициды.
Вспомогательные репродуктивные технологии (ВРТ)
Применение данных методик показано, если наступление беременности без применения ВРТ невозможно (азооспермия, нарушения эякуляции), или бесплодие не поддаётся лечению на протяжении 12 месяцев с момента установления диагноза. Вспомогательные репродуктивные методы включают в себя следующие методики:
- Искусственная инсеминация спермой мужа (ИИСМ) — применяется при нарушении эякуляции (задержка эякуляции), нарушении проникновения сперматозоидов через цервикальную слизь и как первый этап вспомогательных репродуктивных технологий, предшествующий проведению ЭКО. Во время данной процедуры сперму мужа посредством катетера вводят непосредственно в матку женщины в период овуляции.
- Экстракорпоральное оплодотворение (ЭКО) — процедура, во время которой взаимодействие яйцеклетки и сперматозоида осуществляется не в организме женщины, а в специальном сосуде. При этом, если для мужчины это требует лишь сдачи спермы, процедура подготовки женщины к ЭКО значительно сложнее — проводится гормональная стимуляция, в результате которой в яичнике созревают несколько фолликулов, содержащих яйцеклетки. Для получения яйцеклеток фолликулы пунктируют иглой под ультразвуковым наведением. Взаимодействие сперматозоидов и яйцеклеток может привести к образованию эмбрионов. Эмбрионы некоторое время выдерживают в специальных условиях, отбирают 1-2 лучших и переносят в матку женщины. Оставшиеся эмбрионы можно подвергнуть криоконсервации и повторно перенести в матку при безуспешности первой процедуры. Беременность в результате одной процедуры ЭКО развивается примерно у 30% женщин. [10]
- Интрацитоплазматическая инъекция сперматозоидов (ИКСИ) — во время данной процедуры отбирают один сперматозоид и посредством иглы переносят его внутрь яйцеклетки. В остальном процедура аналогична ЭКО. Основные показания к использованию данного метода — низкое качество спермы (малое количество, низкая подвижность и большое количество сперматозоидов с ненормальной морфологией. Эффективность ИКСИ выше ЭКО — частота развития беременности 45%, но безопасность этого метода для потомства вызывает вопросы и окончательно не определена. [10]
Прогноз. Профилактика
Прогноз в отношении мужского бесплодия преимущественно благоприятный. Использование современных методов лечения, в том числе вспомогательных репродуктивных технологий, в большинстве случаев позволяет преодолеть мужской фактор и добиться наступления беременности. Неблагоприятный прогноз для мужчины в отношении возможности иметь детей, как правило, связан с полным отсутствием сперматозоидов не только в эякуляте, но и в яичке (по результатам биопсии или при наличии генетических факторов, исключающих сохранность сперматогенеза).
Далеко не все формы мужского бесплодия можно предотвратить посредством профилактики. Но соблюдение этих простых рекомендаций позволяет значительно снизить вероятность возникновения данного состояния:
Источник https://www.docmilenin.com/%D0%BB%D0%B5%D1%87%D0%B5%D0%BD%D0%B8%D0%B5-%D0%BC%D1%83%D0%B6%D1%81%D0%BA%D0%BE%D0%B3%D0%BE-%D0%B1%D0%B5%D1%81%D0%BF%D0%BB%D0%BE%D0%B4%D0%B8%D1%8F/
Источник https://drakner.ru/clinic/articles/sovremennye-vozmozhnosti-lecheniya-muzhskogo-besplodiya/
Источник https://probolezny.ru/muzhskoe-besplodie/