Острый лейкоз
Острый лейкоз — заболевания крови опухолевой природы, при котором в крови появляются незрелые бластные клетки, образовавшиеся в костном мозге.
Из клеток-предшественников в костном мозге в норме должны образовываться нормально функционирующие зрелые клетки – лейкоциты, эритроциты, тромбоциты. При остром лейкозе происходит злокачественная трансформация гемопоэтических стволовых клеток с образованием морфологически незрелых клеток (бластов), которые вытесняют нормальное кроветворение. В дальнейшем происходит инфильтрация этими клетками различных органов.
Образующиеся в большом количестве незрелые клетки крови в связи с низкой дифференцированностью не обладают свойствами функционально зрелых клеток. При нарушении созревания лейкоцитов это приводит к нарушению иммунитета, нарушение эритроидной и мегакариоцитарной (клетки-предшественники тромбоцитов) линий приводит к нарушению функции переноса кислорода и свертывания крови, что в свою очередь, изменяет нормальную работу всех органов и тканей человека.
По статистике острый лейкоз составляет около 1-2% от всех злокачественных опухолей человека и 20% от всех гемобластозов (опухолей системы крови). Средняя заболеваемость острым лейкозом составляет 5 человек на 100 000 населения.
Острый лимфобластный лейкоз чаще выявляется у лиц молодого возраста. Около 60% людей при этой форме лейкоза моложе 20 лет, и данная форма составляет 30% от всех злокачественных опухолей детского возраста. У пациентов моложе 15 лет острый лимфолейкоз составляет 75 % случаев всех острых лейкозов.
Острый миелобластный лейкоз представляет собой злокачественное изменение миелоидного ростка кроветверения, протекающего с неконтролируемой пролиферацией незрелых клеток миелоидного ряда.
Данное заболевают встречается в среднем у 3–5 человек на 100 тыс. населения в год. При этом заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12–13 случаев на 100 тыс. населения у лиц в возрасте старше 80 лет.

Суперфуды в косметике: сочные коктейли для здоровья кожи и волос
Симптомы
Симптоматика острого лейкоза многообразна.
Клинические признаки острого лимфоблатного лейкоза неспецифичны. К ним относятся: синдром интоксикации — повышение температуры, не связанное с каким-либо инфекционным процессом, нарастающая слабость, снижение веса, потливость по ночам. В ряде случаев заболевание протекает под маской ангины.
При прогрессировании злокачественного процесса и переходе в развернутую стадию на первый план выступают симптомы, связанные с нарастанием количества бластных клеток. В этот период нарастают признаки анемии, отчетливо развиваются геморрагический (повышение кровоточивости) и гиперпластический синдромы. Появляются суставные боли (артралгии) и боли в костях (оссалгия). Прогрессируют признаки интоксикации.
Анемический синдром связан с недостаточной выработкой зрелых эритроцитов, что во всех случаях приводит к развитию гипоксии. Развитие ДВС-синдрома (синдром диссеминированного внутрисосудистого свертывания) часто регистрируется при промиелоцитарном, остром монобластном и остром миеломонобластном лейкозах.
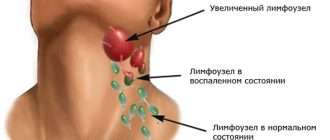
Дальнейшая выработка бластных клеток и увеличение их количества сопровождается гиперпластическим синдромом – образованием лейкемических инфильтратов в костном мозге и других органах (сетчатке, легких, почках, яичках и других органах). Инфильтрация костного мозга и надкостницы сопровождается развитием артралгии и оссалгии. Инфильтрация кожи опухолевыми клетками приводит к появлению лейкемидов (лейкозная инфильтрация кожи – узелки на коже), а появление инфильтратов в печени и селезенки приводит к развитию гепатоспленомегалии. Определяется увеличение различных групп лимфатических узлов.
При развитии тромбоциопении (снижение содержания тромбоцитов) и нарастании геморрагического симдрома при лейкозах отмечаются признаки повышенной кровоточивости — петехии (точечные кровоизлияние), подкожные кровоизлияния, кровоточивость из носа и десен. Относительно редко возможно наличие гематурии (появление крови в моче) и желудочно-кишечных кровотечений.
Повреждение центральной нервной системы происходит при попадании лейкозных клеток в нервную ткань (метастазирование лейкозных клеток в паутинную и мягкую мозговые оболочки головного и спинного мозга) с развитием нейролейкоза (нейролейкемии). Данное состояние сопровождается развитием лейкозного менингита и гипертензивного синдрома (головные боли, судороги, тошнота, косоглазие, нисгагм, отек дисков зрительных нервов, нарушение слуха, ригидность затылочных мышц).
В терминальной стадии развития лейкоза к вышеописанным синдромам присоединяются инфекционные болезни, обусловленные нейтропенией, что часто в сочетании с кровотечениями является причиной смерти.
Острый миелобластный лейкоз характеризуется образованием патологических лейкоцитов, уменьшением содержания эритроцитов и тромбоцитов. Начало заболевания может быть острым – интоксикация, резкая слабость, повышение температуры, кровоточивость. При этой форме лейкоза часто определяется увеличение печени, селезенки и периферических лимфатических узлов. Геморрагический синдром может варьировать от возникновения петехий до тяжелых кровотечений. Как и при остром лимфолейкозе, возможны боли в суставах, костях, возникает неврологическая симптоматика.
Причиной смерти больных с острыми лейкозами становятся инфекционные заболевания, которые возникают из-за нарушения защитной функции лейкоцитов, и геморрагический синдром (состояние характеризующееся кровоточивостью), развивающийся вследствие тромбоцитопении.
Формы
Формы острого лейкоза в зависимости от вида бластных клеток бывают: острые миелоидные лейкозы, острые лимфобластные лейкозы, острые недиференцируемые лейкозы. Выделяют бифенотипические лейкозы – когда различными методами не удается определить принадлежность опухолевых клетки к какому-либо типу, поскольку они имеет маркеры как миелоидных, так и лимфоидных клеток.
Острые лимфобластные лейкозы – это группа разнобразных клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах (группы лейкоцитарных клеток).
Острый лимфобластный лейкоз классифицируют: лимфобластный лейкоз (лимфома) из В-предшественников (острый лимфобластный лейкоз из предшественников В-клеток); лимфобластный лейкоз (лимфома) из Т-предшественников (острый лимфобластный лейкоз из предшественников Т-клеток).
Острый миелоидный лейкоз – это клональное опухолевое заболевание кроветворной ткани, связанное с мутацией в клетке-предшественнице гемопоэза, следствием которой становится блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток.
Основываясь на цитогенетических и молекулярно-генетических особенностях клеток, образующихся при остром миелоидном лейкозе (ОМЛ) его подразделяют на ряд групп: ОМЛ с устойчиво выявляемыми генетическими аномалиями; ОМЛ с генными мутациями; ОМЛ с изменениями, связанными с миелодисплазией; миелоидные неоплазии, связанные с предшествующей химиотераией; ОМЛ, по-другому не специфицированные (NOS); миелоидная саркома; миелоидные опухоли, связанные с синдромом Дауна; опухоль из плазмацитоидных дендритных клеток; острые лейкозы неопределенной линии дифференцировки.
Острый недифференцированный лейкоз – форма лейкоза, который не дифференцируются цитохимическими методами.
Причины
Причины острого лейкоза и канцерогенеза клеток-предшественников кроветворения не выяснены.
Основной причиной появления клона незрелых клеток крови и развития острого лейкоза считают мутации в родоначальной клетке гемопоэза, которая прекратила свою дифференцировку на ранней стадии созревания. Почти у всех больных с острым лейкозом обнаруживаются различные хромосомные нарушения – делеции (удаление части хромосом), транслокации (перенос одной части хромосом на другие хромосомы) и другие изменения.
Дальнейшая бесконтрольная пролиферация таких клеток приводит к накоплению незрелых клеток и угнетению нормального кроветворения.
Показана довольно четкая связь между развитием острого лейкоза и радиационным (лучевым) воздействием. Риск возникновения острого лейкоза повышается после прохождения лучевого лечения по поводу других новообразований. Прослеживается связь возникновения лейкозов и длительного контакта с химическими веществами-канцерогенами, например с бензолом. Вирусное происхождение острого лейкоза доказано для Т-клеточного лейкоза (лимфомы), причиной которого является вирус HTVL1.
Методы диагностики
Диагностика острого лейкоза осуществляется врачом онкологом или гематологом на основании жалоб, данных анамнеза, клинического осмотра, обязательного применения лабораторных (включая генетические) и инструментальных методов обследования. Диагностика направлена на определение клинической формы заболевания, тяжести состояния и возникающих осложнений.
Первым указание на острый лейкоз будет наличие панцитопении (снижение количества клеток крови – эритроцитов, тромбоцитов, нейтофилов) и наличие бластных клеток.
Число лейкоцитов при остром лимфобласном лейкозе может варьировать от 0,5 × 109/л до 700 × 109/л. Увеличение числа лейкоцитов выше 10 × 109/л отмечается у 60 % пациентов, выше 100 × 109/л – у 10 %. Тромбоцитопения менее 50 × 109/л определяется у 60 % пациентов. Определяется снижение количества эритроцитов, нейтрофилов и ускорение СОЭ. Филадельфийская хромосома определяется у 20–30 % взрослых пациентов при В-остром лимфобластном лейкозе.
При остром миелоидном лейкозе в анализах крови в начале болезни может выявляться цитопения трех ростков — снижение количества эритроцитов, тромбоцитов, гранулоцитов. Возможно только лейкопения или лейкоцитоз, тромбоцитопения (в 75% случаев) и анемия различной степени тяжести. Количество ретикулоцитов в пределах нормы или снижено.
Бластные клетки могут не определяться в анализе периферической крови (что составляет определенные трудности в начале диагностике) и, наоборот, составлять 90–95 % всех лейкоцитов. Количество лейкоцитов также варьирует от менее 1,0 до 200–300 ´ 109/л. Примерно в 15 % случаев в дебюте заболевания определяется лейкоцитоз – более 100 ´ 109/л.
Для установления диагноза «острый миелиодный лейкоз» в мазке периферической крови или костного мозга необходимо наличие 20% бластных клеток и более. При наличии генетических изменений — с t(15;17), t(8;21), inv(16) или t(16;16) и при некоторых случаях острого эритромиелоза доля бластных клеток может быть менее 20 %.
При «синдроме распада опухоли» — массивного распада опухолевых клеток, происходящего особенно в период лечения, в биохимическом анализе крови определяется повышенное содержание мочевой кислоты (гиперурикемия), повышение содержания калия и фосфора. Повышается активность фермента лактатдегидрогеназы, также связанная с повышенной гибелью клеток.
Всем пациентам для верификации диагноза рекомендуется выполнить иммунофенотипирование гемопоэтических клеток-предшественниц костного мозга с помощью проточной цитофлуориметрии. Наличие экспресии CD34 и HLA-DR будет говорить в пользу острого миелобластноо лейкоза, экспрессия CD11, D14 и HLA-DR – за наличие острого миелобластного и острого монобластного лейкозов.
Для диагностики лейкозов широко применяются молекулярно-генетические методы, которые позволяет выявлять специфические хромосомные нарушения (транслокации, делеции) и генные перестройки.
Цитогенетические исследования важны не тольно в диагностике острых лейкозов, но в плане определения прогнозов течения заболевания. Например, обнаружение транслокации t (9;22) – трансформация хронического миелолейкоза в острый, свидетельствует о неблагопрятном прогнозе. Неблагоприятным прогнозом также будет характеризоваться наличие делеций в 5 и 7 хомосомах и трисомии по 8 и 13 хромосома, тогда как транслокация t(15,17) в плане течения острого промиелоцитарного лейкоза отличается благоприятным прогнозом. Транслокация t(4,11) определяется при бифенотипическом остром лейкозе и имеет неблагопрятный прогноз.
С целью мониторинга противоопухолевого ответа и выработки тактики дальнейшего лечения при остром лимфобластном лейкозе определяют наличие химерных генов — BCR-ABL,c-MYC-IgH и MLL-AF4.
Основные используемые лабораторные исследования:
- Клинический анализ крови с лейкоцитарной формулой – лейкоцитоз, наличие бластных клеток, признаки анемии, увеличение СОЭ.
- Биохимический анализ крови расширенный (включая ЛДГ, мочевую кислоту, калий, фосфор).
- Коагулограмма.
- Общий анализ мочи (возможна гематурия).
- Исследование ликвора (морфологическое).
- Биохимическое исследование ликвора (белок, глюкоза).
- Цитохимическое исследование клеток костного мозга (мозга на миелопероксидазу, судан, α-нафтилацетатэстеразу с добавлением фторида натрия и без).
- Иммунофенотипическое исследование костного мозга, проточная цитометрия — СD34, СD13, СD33, СD19, СD41, СD61, СD7, СD14, CD15, СD4, CD56, СD11в, HLA-DR, внутриклеточная MПO.
- Миелограмма клеток костного мозга.
- Хромосомный анализ клеток костного мозга.
- Гистологическое исследование пунктатов лимфоузлов.
Дополнительные используемые лабораторные исследования:
- Антитела (IgG) к Т-лимфотропному вирусу человека типа 1 и 2 (Т-клеточный лейкоз и Т-клеточная лимфома).
- Генетические исследования (острый миелолейкоз), гены — CBFB, CEBPA, ETV6, FLT3, GATA2, GMPS, JAK2, KIT, LPP, MLLT10, NPM1, NSD1, NSD3, NUP214, PICALM, RUNX1, TERT.
- Молекулярно-генетическое исследование клеток костного мозга, метод ПЦР: AML/ETO, CBFβ- MYH11, PML-RARальфа, MLL/AF4, МLL/AF9, MLL/ELL, MLL/AF1q, MLL/AF6, MLL/MLL. Также методом прямого сиквенирования рекомендуется исследовать активирующие мутации генов Flt-3 и С-kit.
Основные используемые инструментальные исследования:
- УЗИ лимфатических узлов.
- УЗИ органов брюшной полости (печень, селезенка).
- КТ и МРТ — исследования (по показаниям).
Лечение
Лечение острого лейкоза направлено на уничтожение клона клеток, продуцирующих опухолевые клетки, и восстановление нормального кроветворения.
Основным методом лечения лейкозов является полихимиотерапия (применение нескольких цитостатических препаратов – цитарабина и метотрексата). Длительного безрецидивного периода удается достичь благодаря последующей аллотрансплантации костного мозга (пересадке костного мозга от человека человеку).
В зависимости от морфологиченского типа лейкоза и генетических различий (В-зрелые острые фимфобластные лейкозы; позитивные острые лимфоластные лейкозы по наличию филадельфийской хромосомы; лейкозы — негативные по филадельфийской хромосоме) подходы к лечению будут различаться.
Для иммунологически зрелых В-острых лимфобластных лейкозов доказана эффективность мощного импульсного короткого воздействия в сочетании с анти-CD20- моноклональными антителами. Для Ph-позитивных (наличие филадельфийской хромосомы) острых лимфобластных лейкозов ключевым фактором эффективности является использование ингибиторов abl-тирозинкиназы.
Для пациентов, у которых определяется персистенция минимальной остаточной популяции опухолевых клеток при лимфобластном лейкозе и при остром миелоцитарном лейкозе назначают выполнение аллогенной трансплантации гемопоэтических стволовых клеток.
В профилактических целях, а также при необходимости проводят лечение нейролейкемии (метастазирования бластных клеток в мозговые оболочки).
При лечении острого миелоидного лейкоза назначают индукционную химиотерапию (цель – вызвать полную или частичную ремиссию) по схемам, включающим применение цитарабина и антрациклинов (даунорубицин, идарубицин, митоксантрон).
Часто лечение острого миелобластного лейкоза проводят первый курс по схеме «7+3» — 7-дневное введение цитарабина в сочетании с 3-дневным введением антрациклинов в виде короткой инфузии. При проведении постиндукционной терапии (постремисионной терапии) назначается два и более курсов цитостатических препаратов. При необходимости решается вопрос о проведении аллотрансплантации костного мозга.
Осложнения
Осложнения острого лейкоза -присоединение инфекционных заболеваний, развитие кровотечений, кровоизлияний в головной мозг, желудочно-кишечных кровотечений, нейролейкоза.
Профилактика
Специфической профилактики острого лейкоза не существует.
Какие вопросы следует задать врачу
Можно ли полностью вылечиться от острого лейкоза?
Каким способом можно добиться наибольшей ремиссии?
Советы пациенту
При наличии неспецифических клинических проявлений – таких как слабость, снижение веса, появление кровоизлияний на коже и синяков, наличие ангины, снижение содержания гемоглобина и эритроцитов в крови – следует незамедлительно обратиться к врачу.
Другие болезни крови и кроветворных органов и отдельные нарушения с вовлечением иммунного механизма у беременных
Код (коды) по МКБ-10: O99.1 Другие болезни крови и кроветворных органов и отдельные нарушения с вовлечением иммунного механизма, осложняющие беременность, деторождение или послеродовой период.

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
1. Заболевания крови и кроветворных органов, осложняющие беременность, роды и послеродовый период, не связанные с нарушениями механизмов коагуляционного звена:
— фактор V Лейдена (вариант гена протромбина, антифосфолипидный синдром, волчаночный антикоагулянт, антикардиолипиновые антитела);
2. Отдельные нарушения с вовлечением иммунного механизма, осложняющие беременность, роды и послеродовый период, не связанные с нарушениями механизмов коагуляционного звена: антифосфолипидный синдром.
Факторы и группы риска
3. Фактор V Лейдена (вариант гена протромбина, антифосфолипидный синдром, волчаночный антикоагулянт, антикардиолипиновые антитела)
2. Хирургические процедуры при беременности или после родов (эвакуация задержавшихся остатков последа, послеродовая стерилизация)
Диагностика
3. Нарушение свертывающей системы крови (протромбиновый индекс более 105 %, тромботест II-III стадии, концентрация общего фибриногена меньше или больше нормы (2-4 г/л); наличие фибриногена В, положительный этаноловый тест).
4. Нарушение факторов свертывания крови (врожденная недостаточность антитромбина, недостаточность протеина С, S, мутация гена Лейдена).
1. Развернутая гемостазиограмма с определением врожденной недостаточности антитромбина, недостаточности протеина С, S, дефекта гена Лейдена по показаниям.
Лечение
Наиболее грозным осложнением данной группы заболеваний является возникновение тромбозов во время беременности, родов или послеродовом периоде, что является частой причиной материнской смертности.
Пациенткам с предшествующими эпизодами венозной тромбоэмболии без подтвержденной тромбофилии в течение 6 недель после родоразрешения должна быть проведена профилактика препаратами низкомолекулярного гепарина (НМГ).
У пациенток с предшествующим рецидивирующим венозным тромбозом и наличием семейного анамнеза показано проведение профилактики тромбоза препаратами НМГ в антенатальный период.
У пациенток с предшествующими тромбозами в результате тромбофилии (особенно при Леденовской мутации и мутации протеина С,S) риск тромбоза при беременности, в родах и послеродовом периоде значительно возрастает. Пациенткам данной группы показана постоянная профилактика НМГ в антенатальный период и в течение 6 недель после родоразрешения.
Антифосфолипидный синдром (АФС). Диагноз ставится при наличии в крови беременной волчаночного антикоагулянта или кардиолипиновых антител, выявляемых с интервалом 8 недель, в сочетании с указанием на эпизоды тромбоза (артериального или венозного) в анамнезе, неблагоприятными исходами беременности (3 и более выкидышей в сроках до 10 недель беременности, причина которых не установлена, внутриутробная гибель плода в сроках более 10 недель беременности, присоединение тяжелой преэклампсии или внутриутробной задержки развития плода, преждевременных родов в сроках беременности до 35 недель).
Пациенткам с АФС в виду высокого риска возникновения тромбоза (70%) необходимо проведение профилактики НМГ в антенатальный период.
Профилактика низкими дозами аспирина у пациенток данной группы улучшает исходы беременности и рекомендуется всем беременным [1,2].
Пациентки без предшествующих эпизодов тромбоза или тромбофилии. Пациенткам с 3 и б олее текущими или персистирующими факторами риска должна проводиться профилактика препаратами НМГ в антенатальном периоде и в течение 3-5 дней после родов. Пациенткам с 2 факторами риска, а также беременным старше 35 лет с массой тела более 90 кг профилактика препаратами НМГ проводится в течение 3-5 дней после родов.
При принятии решения о необходимости профилактики тромбоза в антенатальный период, профилактика должна начинаться с ранних сроков беременности и продолжаться вплоть до родоразрешения.
3. Эластическое бинтование нижних конечностей рекомендуется для профилактики тромбозов в антенатальном периоде.
4. Варфавин должен быть исключен для профилактики тромбозов при беременности из-за выраженного тератогенного действия.
5. Препараты декстрана не используются при беременности за счет высокого риска анафилактических реакций, выраженного нарушения плодово-плацентарного кровообращения и гипертонуса матки.
1. *Надропарин кальция 2850 МЕ анти-Ха/0,3мл; 3800 МЕ анти-Ха/0,4мл; 5700 МЕ анти-Ха/0,6мл; 7600 МЕ анти-Ха/0,8мл, 9500 МЕ анти-Ха/1,0 мл по 0,3 мг
— при гипоксии плода – лечение гипоксии плода.
Индикаторы эффективности лечения: выбор оптимальной тактики лечения.
Профилактика
Первичная профилактика: профилактические мероприятия по предотвращению воздействия факторов риска на развитие заболевания.
Информация
Источники и литература
- Протоколы диагностики и лечения заболеваний МЗ РК (Приказ №764 от 28.12.2007)
- Список использованной литературы: 1. Royal College of Obstetricians and Gynecologist. Setting Standart to Improve Women’s Health. Thromboprophylaxis During Pregnancy, Labour and After Vaginal Delivery. Evidence-based Clinical Guideline #37, 2004, p.13 2. Royal College of Obstetricians and Gynecologist. Setting Standart to Improve Women’s Health. Thromboembolic Disease in Pregnancy and Puerperium: Acute Managment. Evidence-based Clinical Guideline #28, 2001, p.13 3. SOGC Clinical Practice Guidelines: Gynaecological and Obstetric Managment of Women With Inherited Bleeding Disorders.- #163, July, 2005.- p.707-718 4. Institute for Clinical Systems Improvement. Health Care Guideline. Rutine Prenatal Care, 2005, p.80 5. National Collaborating Center for Women’s and Children’s Health. Antenatal Care: Rutine Care for the Healthy Pregnant Women. Clinical Guideline, 2003, p.286
Информация
Список разработчиков: Сапарбекова А.З. к.м.н., с.н.с. Республиканского Научно- исследовательского Центра охраны здоровья матери и ребенка (РНИЦОЗМиР).
Коагулопатия
Коагулопатии – это гематологические синдромы, характеризующиеся нарушением гемостаза по типу гипо- или гиперкоагуляции. Расстройства гемокоагуляции проявляются геморрагическим синдромом (кровотечениями из носа, десен, ран, подкожными геморрагиями), тромбозами различной локализации. Коагулопатии диагностируются по данным гематологических исследований: ОАК, коагулограммы, факторов свертывания, тромбоцитов, аутоантител и др. Терапия зависит от нарушенного звена гемостаза, может включать гемотрансфузии, назначение глюкокортикоидов, витаминов, антикоагулянтов, проведение хирургического вмешательства.
МКБ-10


Общие сведения
Коагулопатии объединяют различные состояния, сопровождающиеся как снижением, так и повышением свертываемости крови. По статистике ВОЗ, около 5 млн. человек в мире страдает геморрагическим синдромом. Нарушения гемостаза лабораторно определяются у 66%, а клинически ‒ у 16% пациентов ОРИТ. С расстройствами гемокоагуляции в повседневной практике могут столкнуться не только специалисты в области гематологии, но и акушеры-гинекологи, педиатры, хирурги, травматологи, кардиологи. Коагулопатии значительно утяжеляют прогноз основных заболеваний, требуют оказания ургентной медицинской помощи.

Причины коагулопатии
Основным механизмом нарушений гемостаза выступает дисбаланс в свертывающей и противосвертывающей системах крови. Коагулопатии развиваются под влиянием наследственных, эндогенных и экзогенных факторов. Основные группы причин:
- Генетические предпосылки. Наследственные патологии гемостаза связаны с молекулярными дефектами плазменных и тромбоцитарных факторов свертывания, врожденными аномалиями сосудистой стенки. Дефицит факторов VIII и IX лежит в основе гемофилий, дефицит фактора Виллебранда ‒ в основе болезни Виллебранда, фактора VII – гипопроконвертинемии, фактора X – болезни Стюарта-Прауэра и т.д. Примером тромбоцитопатий служит тромбастения Гланцмана.
- Сопутствующие состояния. Влияние на функцию гемостаза оказывают гипокальциемия, гиповитаминоз К, гемодилюция, кровотечения. Коагулопатиями сопровождаются бактериальные (сепсис) и вирусные инфекции (гемоорагические лихорадки, COVID-19), онкопатологии (острый лейкоз), болезни печени (цирроз, синдроме Бадда–Киари), укусы змей семейства гадюковых.
- Фармакотерапия. Неправильный подбор дозировки антиагрегантов и антикоагулянтов приводит к тромбоцитопатиям и гипокоагуляции. Гиперкоагуляция является побочным эффектом КОК, кортикостероидов. Использование больших объемов коллоидных растворов для восполнения ОЦК может вызвать геморрагический синдром.
- Аутоиммунные реакции. В отдельную группу выделяют аутоиммунные коагулопатии, вызванные образованием антител к свертывающим факторам. Триггерами выступают перенесенные инфекции, вакцинация, инсоляция, радиация. Наиболее частыми и клинически значимыми в этом отношении являются антифосфолипидный синдром, идиопатическая тромбоцитопеническая пурпура, HELLP-синдром и др.
- Медицинские манипуляции. Риск развития гиперкоагуляции существует при контакте крови с искусственными материалами (клапанные протезы, внутрисосудистые стенты, аппараты ИК, ЭКМО и др.).
Патогенез
Основными структурно-функциональными компонентами гемостаза являются сосудистая стенка, форменные элементы крови и факторы свертывания плазмы. Первичный (сосудисто-тромбоцитарный) гемостаз осуществляется эндотелием и субэндотелием сосудов совместно с тромбоцитами. Вторичный (коагуляционный) гемостаз реализуется плазменными свертывающими и противосвертывающими факторами. Коагулопатии могут развиваться при патологии любого из этих звеньев.
Нормальная неповрежденная сосудистая стенка обладает антитромботическими свойствами, что обеспечивает беспрепятственную циркуляцию крови по сосудам. Различные патогенные факторы (бактериальные токсины, ЦИК, провоспалительные цитокины) вызывают повреждение эндотелия, в результате чего усиливаются его прокоагулянтные свойства.
Происходит усиленная адгезия и агрегация тромбоцитов, активация плазменных факторов при одновременном угнетении антикоагулянтных факторов и фибринолиза. Гиперкоагуляция ведет к формированию внутрисосудистых тромбов, ишемии тканей и инфарктам органов. При ДВС-синдроме развивается генерализованный тромбоз и полиорганная недостаточность.
Коагулопатии, протекающие по типу гипокоагуляции, могут быть вызваны заболеваниями сосудов (вазопатиями), снижением количества тромбоцитов (тромбоцитопенией) или их дефектами (тромбоцитопатией), дефицитом факторов свертывания, повышением антикоагулянтной или фибринолитической активности (гемостазиопатии). При этом развивается повышенная кровоточивость ‒ геморрагический синдром.

Классификация
По времени и причинам возникновения коагулопатические синдромы подразделяют на наследственные и приобретенные. По характеру изменений гемостаза дифференцируют гипокоагуляцию и гиперкоагуляцию. С учетом клинических проявлений различают следующие виды коагулопатий:
- Тромбофилические – характеризуются возникновением тромбозов и тромбоэмболий (АФС, полицитемия, геморрагический васкулит).
- Геморрагические – проявляются склонностью к спонтанным и посттравматическим кровотечениям (гемофилии, афибриногенемия, тромбастения Гланцмана, геморрагическая болезнь новорожденных и др.).
- Тромбогеморрагические – протекают с множественными тромбозами и геморрагиями (ДВС-синдром).
В зависимости от нарушенного звена свертывающей системы выделяют три класса приобретенных коагулопатий:
- Патологии тромбоцитарного гемостаза: болезнь Мошковица, болезнь Верльгофа, HELLP-синдром, тромбоцитопатии.
- Патологии коагуляционного гемостаза: передозировка антикоагулянтов, гемофилия, дефицит витамина К.
- Смешанные нарушения гемостаза: при болезнях печени, уремии, полиорганной дисфункции.
Также существует деление коагулопатий на следующие группы:
- вазопатии – поражение сосудистой стенки (болезнь Рандю-Ослера, синдром Казабаха-Мерритта, капилляротоксикоз);
- тромбоцитопатии – структурные и функциональные аномалии тромбоцитов (тромбастения Гланцмана, болезнь Виллебранда);
- тромбоцитопении – количественное уменьшение тромбоцитов (болезнь Верльгофа);
- гемостазиопатии – дефицит свертывающих факторов, повышенный фибринолиз (К-зависимые коагулопатии, патологии печени).
Симптомы коагулопатий
Синдром гиперкоагуляции
Гиперкоагуляционные синдромы характеризуются высоким риском тромбообразования. Клинические проявления могут полностью отсутствовать, тогда коагулопатия диагностируется только лабораторным путем. В других случаях отмечается быстрое свертывание крови при небольших ранениях, тромбирование венозных катетеров и игл при заборе крови.
Клиника симптоматических тромбозов зависит от вида и калибра закупоренного сосуда, локализации кровяного сгустка. Серьезную опасность представляют инфаркты органов: сердца, мозга, почек, кишечника, легких. Артериальные тромбозы приводят к инфаркту миокарда, ишемическому инсульту, окклюзии мезентериальных сосудов, гангрене конечностей, потере плода у беременных. Тромбозы глубоких вен являются источником тромбоэмболии легочной артерии.
Наиболее типичным клиническим признаком тромбоза является боль, зависящая от локализации тромба: головная боль в груди, животе, пояснице и т.д. Возможны слабость, одышка, онемение конечностей, судороги. Без своевременной медицинской помощи наступает необратимый некроз органа, нередко ‒ летальный исход.
Синдром гипокоагуляции
Геморрагические синдромы сопровождаются повышенной кровоточивостью. Кровотечения капиллярного типа проявляются образованием петехий и экхимозов на кожных покровах, носовыми кровотечениями, меноррагиями, иногда – внутримозговыми кровоизлияниями.
Гематомная кровоточивость приводит к кровоизлияниям в полости тела и мышцы. При коагулопатиях такого рода формируются болезненные подкожные гематомы, гемартрозы, гематомы забрюшинной области. Могут возникать желудочно-кишечные кровотечения, гематурия, длительное кровоистечение после ранений, экстракции зубов, хирургических операций.
Ангиоматозные кровотечения развиваются из аномальных сосудов: ангиом, телеангиэктазий, артериовенозных мальформаций. Васкулитно-пурпурной кровоточивости свойственно наличие геморрагической сыпи, воспалительной эритемы, нефрита на фоне системных васкулитов.
Следствием геморрагических коагулопатий является железодефицитная анемия. Одномоментная массивная кровопотеря может привести к геморрагическому шоку и смерти.

Диагностика
В диагностике коагулопатий принимают участие гематологи-гемостазиологи, кардиологи, иммунологи, флебологи и др. Основными диагностическими критериями являются лабораторные показатели различных звеньев гемостаза:
- Коагулогические тесты. Расширенная коагулограмма включает около 20 различных позиций: протромбиновое и тромбиновое время, МНО, ПТИ, время кровотечения, АЧТВ, этаноловый тест, фактор Виллебранда, антитромбин III, фибриноген, D-димер, плазминоген и др. Исследуется количество и морфология тромбоцитов. При необходимости выполняется тромбоэластография.
- Серологические тесты. При подозрении на АФС осуществляется поиск антител к бета-2-гликопротеину, кардиолипину, исследование АНФ, волчаночного антикоагулянта. При тромбоцитопенической пурпуре исследуют Ат к тромбоцитам, при васкулитах ‒ Ат к цитоплазме нейтрофилов.
- Другие гематологические тесты. Обязательно проводятся клинические анализы мочи и крови, биохимические исследования (кальций, витамин К, печеночные ферменты и др.). При различных коагулопатиях может потребоваться синдромальная генодиагностика, биопсия костного мозга с изучением миелограммы.
- Инструментальные исследования. Диагностика тромбозов осуществляется с помощью ультразвуковых (УЗДГ артерий и вен) и рентгеновских (ангиография) методов. При кровотечениях прибегают к эндоскопическим исследованиям (гастроскопия, колоноскопия, бронхоскопия, лапароскопия), эхографии (УЗИ забрюшинного пространства, суставов, мягких тканей).
Лечение коагулопатии
Терапия гиперкоагуляции
В лечении тромбозов находят применение антиагреганты, антикоагулянты непрямого и прямого действия, фибринолитические препараты, ангиопротекторы. При венозных тромбозах, ишемическом инсульте прибегают к регионарному катетерному тромболизису. С целью удаление из кровеносного русла ЦИК, токсинов, продуктов фибринолиза проводится плазмаферез, цитаферез. При коагулопатиях аутоиммунного генеза назначаются глюкокортикостероиды, цитостатики, иммуноглобулины.
Терапия гипокоагуляции
Для купирования коагулопатий, сопровождающихся кровотечениями, осуществляется местный и общий гемостаз. Во всех случаях, кроме симптоматического лечения, необходимо проведение этиопатогенетической терапии.
- Местный гемостаз. Для остановки капиллярных кровотечений применяются гемостатические губки, фибриновый клей, электрокоагуляция. Широко используется инъекционный гемостаз, склеротерапия, орошение гемостатическими растворами.
- Системная гемостатическая терапия. Для купирования кровотечений используются инъекции коагулянтов, витамина К, инфузии хлористого кальция, антифибринолитиков. Гемотрансфузии могут заключаться в переливании свежезамороженной плазмы, тромбоцитарной массы, тромбоконцентрата, криопреципитата.
- Хирургический гемостаз. При отсутствии эффекта от консервативной терапии прибегают к различным способам малоинвазивного (баллонная тампонада, эндоскопическое клипирование сосудов) или радикального хирургического гемостаза (спленэктомия, гистерэктомия и пр.).
Прогноз и профилактика
Любые нарушения гемостаза являются потенциально опасными для жизни. Однако при соблюдении всех мер предосторожности и следовании врачебным рекомендациям риск фатальных кровотечений и тромбозов минимален. Для предупреждения приобретенных коагулопатий не следует запускать хронические заболевания, бесконтрольно принимать лекарственные препараты, подвергаться избыточной инсоляции и другим неблагоприятным экзогенным воздействиям. Профилактика наследственных коагулопатий возможна только путем проведения генетического скрининга.
1. Приобретенные коагулопатии: современные подходы к дифференциальной диагностике и интенсивной терапии с позиции доказательной медицины/ Синьков С.В., Заболотских И.Б., Шапошников С.А.// Общая реаниматология. – 2007. – III; 5-6.
2. Гиперкоагуляционный синдром: классификация, патогенез, диагностика, терапия/ Воробьев А.И., Васильев С.А., Городецкий В.М., Шевелев А.А., Горгидзе Л.А. и др.// Гематология и трансфузиология. – 2016.
Источник https://medaboutme.ru/zdorove/spravochnik/bolezni/ostryy_leykoz/
Источник https://diseases.medelement.com/disease/12940
Источник https://www.krasotaimedicina.ru/diseases/hematologic/coagulopathy