Биоаналоги в лечении ревматических болезней: pro et contra
Генно-инженерные биологические препараты (ГИБП) в настоящее время достаточно широко применяются для лечения многих ревматических болезней, в том числе ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, системных васкулитов и др. Чаще всего их используют в качестве препаратов второй линии в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов. Основным препятствием к более частому назначению ГИБП является их высокая стоимость, которая приводит к увеличению затрат на лечение и экономического бремени для системы здравоохранения. Частичным решением этой проблемы является создание экономически более привлекательных биоаналогов ГИБП, которое стало возможным после завершения срока патентов на некоторые оригинальные препараты. Однако следует учитывать, что ГИБП, в отличие от синтетических лекарственных средств (“малых молекул”), характеризуются сложным и многоэтапным процессом производства, что определяет строгие требования к их разработке и регистрации. Чтобы гарантировать не менее высокую эффективность и безопасность биоподобных препаратов по сравнению с оригинальными, потенциальные биоаналоги следует тщательно изучать не только в доклинических, но и рандомизированных контролируемых клинических исследованиях. Сбор данных о безопасности и эффективности биоаналога необходимо продолжать и после его регистрации и внедрения в клиническую практику. В статье обсуждаются результаты клинических исследований российских биоаналогов ритуксимаба, инфликсимаба и адалимумаба, которые были одобрены для применения при ревматических заболеваниях.
Генно-инженерные биологические препараты (ГИБП) применяются в ревматологии на протяжении двух десятилетий. За это время список их значительно пополнился и продолжает расширяться (ингибиторы фактора некроза опухоли [ФНО]-α, В-лимфоцитов, рецепторов интерлейкина-6, костимуляции Т-лимфоцитов, интерлей кинов-12/23, интерлейкина-17, интерлейкина-1), как и показания к применению. Последние сегодня включают не только ревматоидный артрит, но и многие другие ревматические заболевания, в том числе редкие. К настоящему времени у некоторых ГИБП закончился срок патентной защиты, в связи с чем начался процесс регистрации их аналогов. На сегодняшний день в Российской Федерации для лечения ревматических заболеваний были одобрены биоаналоги инфликсимаба (инфликсимаб, BIOCAD, Россия, и Фламмэгис, Celltrion Pharm, Республика Корея), ритуксимаба (Ацеллбия, BIOCAD, Россия) и адалимумаба (Далибра, BIOCAD, Россия.)
Современные принципы разработки биоаналогов
Появление более дешевых биоаналогов приводит к снижению затрат для системы здравоохранения, в том числе за счет падения цен на оригинальные ГИБП, что позволяет охватить лечением большее число пациентов. Например, в одном исследовании было показано, что появление биоаналогов на американском рынке в течение ближайшего десятилетия позволит сократить расходы бюджета более чем на 44 млрд долларов при условии, что стоимость биоподобных препаратов будет на 35% ниже оригинальных ГИБП [1]. Однако очевидно, что сокращение затрат не должно происходить в ущерб эффективности и безопасности лечения ГИБП. В связи с этим в литературе последних лет активно обсуждаются требования к процессу регистрации биоаналогов, в частности необходимость в проведении рандомизированных клинических исследований для подтверждения их сопоставимых эффективности и безопасности по сравнению с оригинальным ГИБП [2-5]. Если подобные исследования не проводились, то препарат предлагается считать “предполагаемой копией» (intended copy) референтного ГИБП, а не биоаналогом.
ГИБП, применяющиеся для лечения ревматических заболеваний, представляют собой сложные белковые молекулы (моноклональные антитела, циркулирующие рецепторы, гибридные молекулы), которые производятся с помощью генно-инженерного метода и, в отличие от низкомолекулярных препаратов, не являются точными копиями оригинальных веществ. Это связано с тем, что даже незначительные изменения процесса производства белковых молекул могут привести к изменению их биологической активности и/или иммуногенности и, соответственно, безопасности и эффективности [3]. Свойства белков могут зависеть и от трудно воспроизводимых посттрансляционных изменений, таких как гликозилирование, окисление, метилирование и/или деаминирование [5].
В последние годы Всемирная организация здравоохранения (ВОЗ) и регуляторные органы Европейского Союза и США предложили определения биоаналогов. Например, ВОЗ считает таковыми биотерапевтические препараты, которые по качеству, безопасности и эффективности подобны зарегистрированным референтным препаратам [6]. В определении Европейского агентства по лекарствам (ЕМА) и сходном определении Евразийской экономической комиссии указано, что подобие биоаналога референтному препарату по параметрам качества, биологической активности, безопасности и эффективности должно быть подтверждено при всестороннем исследовании сопоставимости [7,8]. В определении Американского управления по контролю качества пищевых продуктов и лекарств (FDA) отмечается возможность незначительных различий в клинически неактивных компонентах между биоаналогом и зарегистрированным в США оригинальным ГИБП при отсутствии клинически значимых различий по безопасности, чистоте и активности [9].
Сегодня большинство экспертов сходятся во мнении, что регистрация биоаналога должна производиться на основании результатов не только доклинических, но и клинических исследований 3 фазы, предполагающих прямое сравнение потенциального биоаналога с оригинальным ГИБП (рис. 1) [2,5]. Таким образом, фактически программа разработки биоаналога в значительной степени соответствует таковой оригинального препарата за исключением отсутствия необходимости в проведении исследований 2 фазы, предполагающих изучение режимов введения и выбор оптимальных доз препарата. Регуляторные органы Европы и США, а также Евразийская экономическая комиссия считают целесообразным придерживаться пошагового подхода при изучении биоаналогов [7-9]. При этом объем и характер доклинических и клинических исследований зависят от результатов, полученных на предыдущем этапе. Следует отметить, что необходимо учитывать все полученные данные, а не отдавать предпочтение тому или иному аспекту. Цель любых исследований – выявление потенциальных различий между биоаналогом и оригинальным ГИБП и установление клинического значения различий, если, конечно, таковые будут обнаружены [2].
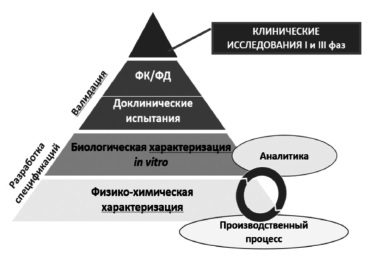
Рис. 1. Совокупность доказательств (totality of evidence) – основной принцип подтверждения биоподобия. ФК/ФД – фармакокинетика/фармакодинамика
В доклинических исследованиях изучают аминокислотную последовательность, физико-химические свойства, показатели качества белков, подтверждают сопоставимость серий биоаналога и оригинального ГИБП по различным характеристикам, таким как наличие заряженных изоформ, гликозилирование и другие посттрансляционные изменения, составу примесей [8]. Ключевое значение имеет сравнение функциональных свойств ГИБП, таких как связывание моноклональных антител с антигеном-мишенью или Fc-рецепторами, антителозависимая клеточная и комплементзависимая цитотоксичность, активация комплемента [8]. Методы анализа должны быть достаточно чувствительными для выявления различий зависимости активности от концентрации между биоподобным и референтным препаратами. Это означает, что в доклинических исследованиях важно не просто показать наличие у белка определенного свойства, а доказать, что по соответствующему показателю он не отличается от оригинального ГИБП, т.е. является биоподобным.
Такая же цель преследуется в клинических исследованиях, в которых изучают фармакокинетическую и фармакодинамическую эквивалентность биоаналога и оригинального ГИБП (границы сопоставимости по первичным параметрам обычно составляют 80-125%) и подтверждают их сопоставимые клиническую эффективность и безопасность.
Как указано выше, необходимым этапом разработки биоаналога является подтверждение его сопоставимости с оригинальным ГИБП в рандомизированном контролируемом исследовании 3 фазы, которое следует проводить в наиболее “чувствительной» выборке пациентов [2]. Такие исследования должны быть достаточно продолжительными, чтобы изучить сохранение достигнутого ответа в отдаленные сроки и безопасность и иммуногенность более длительной терапии. Одно вре менно сопоставление результатов лечения в более ранние сроки, например, через 8-12 недель, позволяет сравнить скорость действия препаратов сравнения [10]. Выбор критериев эффективности в сравнительных клинических исследованиях должен быть научно обоснованным. При оценке эффективности необходимо свести к минимуму роль факторов, которые зависят от пациента и заболевания.
Любые белки обладают иммуногенностью, т.е. могут вызывать образование антител, в том числе нейтрализующих, которые нивелируют эффективность лечения ГИБП. По иммуногенности биоаналоги могут гипотетически отличаться от оригинальных препаратов, особенно если в процессе их производства используются иные экспрессирующие конструкции, которые могут привести к модификации свойств биологического препарата [8]. Соответственно, при проведении сравнительного клинического исследования необходимо определять общую частоту образования антител и частоту образования как связывающих, так и особенно нейтрализующих антител, а также их влияние на эффективность ГИБП. Изучение иммуногенности более информативно у пациентов, которым ранее не проводилась терапия ГИБП [11]. В идеале они также не должны получать сопутствующую терапию иммуносупрессивными препаратами. Необходимо учитывать, что иммуногенность ГИБП может зависеть от дозы ГИБП, генетических факторов, особенностей заболевания [2]. Например, в сравнительных клинических исследованиях оригинального инфликсимаба и его биоаналога частота антител к инфликсимабу у пациентов с ревматоидным артритом, получавших инфликсимаб в дозе 3 мг/кг и метотрексат, была выше, чем у больных анкилозирующим спондилитом, которым проводили терапию одним инфликсимабом в дозе 5 мг/кг [12,13].
Экстраполяция показаний к применению биоаналого
Нужно ли подтверждать биоподобие биоаналога и референтного препарата по каждому показанию к применению? Некоторые специалисты считают необходимым проводить рандомизированные клинические исследования по каждому зарегистрированному показанию [14,15]. Однако подобная практика представляется чрезмерной. По мнению группы экспертов, если на этапе доклинических исследований доказана эквивалентность качественных и функциональных характеристик, а в рандомизированном клиническом исследовании подтверждена сопоставимость клинической эффективности и безопасности биоаналога оригинальному препарату по крайней мере по одному показанию, то полученные данные могут быть экстраполированы на другие показания, по которым биоаналог не изучался [2]. Данная практика правомочна в отношении тех показаний, при которых механизм действия одинаков. Так, многие ГИБП в ревматологии применяются по различным показаниям, например, ингибиторы ФНО-α используют для лечения ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, а также псориаза и воспалительных заболеваний кишечника. Cпециально изучать фармакокинетические свойства или клиническую эффективность биоаналогов ингибиторов ФНО-α у пациентов со всеми заболеваниями, которые служат показаниями к их применению, не имеет особого смысла, учитывая однотипную роль ФНО-α в иммуновоспалительном процессе [2]. Однако некоторые ГИБП, например, ритуксимаб, используются у пациентов не только с ревматическими, но и онкологическими заболеваниями, что может потребовать проведения отдельных фармакокинетических исследований, учитывая потенциальные различия мишень-опосредованного клиренса.
В настоящее время экстраполяция показаний для биоаналогов стала общемировой практикой, которая позволяет производителю не только сократить затраты на клинические исследования и обеспечить препарату более привлекательную стоимость, но и быстрее внедрить его в клиническую практику.
Переключение пациентов с оригинального препарата на биоаналог
Применение биоаналогов в качестве первого ГИБП получает все большее распространение, так как подобная практика увеличивает доступность современных методов лечения для пациентов и ограничивает рост затрат системы здравоохранения. Однако для практикующего специалиста остро стоит вопрос о возможности переключения пациентов с оригинальных ГИБП на биоаналоги. Этот вопрос изучался в клинических исследованиях [16-19] и затрагивается в последних международных рекомендациях по ревматоидному артриту [20] и анкилозирующему спондилиту [21]. В клинической практике можно встретить следующие ситуации, связанные с переключениями между референтным препаратом и его биоаналогом.
- Оригинальный препарат эффективен, однако для уменьшения финансовых затрат учреждения/области/ региона может быть рекомендовано переключение на биоаналог с аналогичным международным непатентованным названием (МНН). Данное переключение, как правило, вызывает наименьшее количество вопросов и у клиницистов, и у регуляторов [2]. Более того, по мнению группы экспертов нет оснований ожидать снижение эффективности лечения при переключении между двумя биоаналогами [2]. Недавно Норвежское агентство по лекарствам (Norwegian Medicines Agency) предложило разрешить автоматическую замену оригинальных препаратов на биоаналоги на уровне аптеки [22]. При этом важно предоставить пациенту адекватную информацию о качестве и изученности предлагаемого биоаналога, чтобы избежать эффекта ноцебо и “снижения» эффективности терапии, которое может быть связано с недоверием к новому препарату. Кроме того, остается открытым вопрос иммуногенности при множественных переключениях между биоаналогами и оригинальным препаратом или между биоаналогами в рамках одного МНН.
- Оригинальный препарат эффективен, однако для уменьшения финансовых затрат учреждения/области/ региона может быть рекомендовано переключение на биоаналог с другим МНН. Данное переключение требует веского обоснования, так как смена МНН даже внутри одного класса (например, среди ингибиторов ФНО-α) может привести к потере клинического эффекта.
- Оригинальный препарат неэффективен и обсуждается переключение на биоаналог. В подобной ситуации очевидно, что переключение следует проводить на биоподобный препарат с другим МНН, так как продолжение лечения неэффективным препаратом клинически нецелесообразно [20,21]. К сожалению, к настоящему времени накоплено недостаточно информации об оптимальных схемах переключения даже между оригинальными ГИБП, и тем более почти совсем нет опыта переключения с референтных препаратов на биоаналоги с другими МНН.
Российская практика разработки и применения биоаналогов
С 2017 г. в Российской Федерации по ревматическим показаниям зарегистрировано 3 биоаналога ГИБП российского производства: ритуксимаб (Ацеллбия, BIOCAD), инфликсимаб (Инфликсимаб, BIOCAD) и адалимумаб (Далибра, BIOCAD). Разработка и полный цикл локального производства российских биоаналогов позволили выпустить на рынок препараты высокого качества по более конкурентной цене. Ниже мы приводим краткий обзор клинических исследований данных биоподобных препаратов.
Биоаналог ритуксимаба (Ацеллбия®) . Регистрационное исследование препарата Ацеллбия® (BCD-020, МНН: ритуксимаб) – BIORA – проводилось у пациентов с серопозитивным ревматоидным артритом на базе 21 аккредитованного лечебного центра в России, Беларуси, Украине и Индии [23,24]. Эффективность терапии оценивали у 160 пациентов, 83 из которых получали биоаналог, а 77 – референтный ритуксимаб (Мабтера®). Пациенты двух групп были сопоставимы по возрасту, антропометрическим показателям, продолжительности (в среднем около 7 лет) и активности заболевания. Для оценки эффективности терапии исполь зовали критерии Американской коллегии ревматологов (ACR)/Европейской антиревматической лиги (EULAR) и критерии ACR (ACR20/50/70). Исследо вание проводилось в два этапа: первый – оценка биоподобия (24 недели), второй – оценка взаимозаменяемости (24 недели).
Через 24 недели после начала лечения частота улучшения по критериям ACR20 в группе пациентов, получавших биоаналог ритуксимаба, составила 84,1% (95% доверительный интервал [ДИ] 74,8–90,5), а в группе сравнения – 87,0% (95% ДИ 77,7–92,8). Разница между группами была недостоверной (р=0,773) [23]. На втором этапе исследования, когда изучались результаты переключения пациентов, ранее получавших лечение референтным препаратом, на биоаналог, и наоборот, не было отмечено изменений эффективности, безопасности и иммуногенности терапии.
В Российской Федерации зарегистрированные показания к применению референтного ритуксимаба и его биоаналога в ревматологии включают в себя не только ревматоидный артрит, но и АНЦА-ассоциированные васкулиты – гранулематоз с полиангиитом и микроскопический полиангиит. Регистрационное исследование препарата Ацеллбия у пациентов с АНЦА-ассоциированными васкулитами не проводилось, т.е. это показание было зарегистрировано на основании опыта изучения оригинального ГИБП и принципа экстраполяции. Следует отметить, что эффективность и безопасность Ацеллбии были показаны в ретроспективном исследовании у 42 больных АНЦА-ассоциированным васкулитом, выполненном на базе Клиники им. Е.М. Тареева (Москва) [25].
Биоаналог инфликсимаба (Инфликсимаб). Российский биоаналог Инфликсимаб (BCD-055) был зарегистрирован в Российской Федерации на основании результатов двух клинических исследований 3 фазы: ASART-2 (анкилозирующий спондилит) и LIRA (ревматоидный артрит). Биоаналог сравнивали с референтным препаратом Ремикейд® (“МСД Фармасьютикалс»).
В международное многоцентровое, рандомизированное, двойное слепое клиническое исследование ASART2 были включены 199 пациентов с анкилозирующим спондилитом, которых рандомизировали на две группы в соотношении 2:1. Им назначали BCD-055 или Ремикейд в дозе 5 мг/кг в режиме 0–2–6-я неделя, затем каждую 8-ю неделю. Результаты оценивали через 14, 30 и 54 недель у всех рандомизированных пациентов, получивших хотя бы одну дозу инфликсимаба (выборка intent-to-treat; ITT), и через 54 недели у пациентов, завершивших участие в исследовании согласно протоколу (выборка per protocol; РР). Частота ответа по критериям ASAS20 и ASAS40 через 14, 30 и 54 недели была сопоставимой в группах сравнения (р>0,05) [26]. Через 54 недели доля пациентов, достигших ответа по критериям ASAS20 при лечении BCD-055 и Реми кей дом, в выборке ITT составила 67,4% и 52,2%, соответственно (р=0,053), а в выборке РР – 80,9% и 68,6% (р=0,128). Частота ответа по критериям ASAS40 в двух группах составила, соответственно, 53,0% и 38,8% в выборке ITT (р=0,081) и 63,6% и 50,9% в выборке РР (р=0,177) [26].
В многоцентровом исследовании LIRA у 426 пациентов с активным ревматоидным артритом, рандомизированных на две группы в соотношении 2:1 (BCD-055 и Ремикейд), биоаналог инфликсимаба не отличался от референтного ГИБП по частоте ответа по критериям ACR20/50/70 и частоте ремиссии по критерию ACR/ EULAR [27].
Биоаналог адалимумаба (Далибра®). В 2019 году был зарегистрирован российский биоаналог адалимумаба (Далибра®). Регистрационное исследование 3 фазы проводилось у 346 пациентов со средне-тяжелым и тяжелым псориазом, которые были рандомизированы на две группы в соотношении 1:1. В этом исследовании была установлена эквивалентность исследуемого препарата BCD-057 (Далибра®, BIOCAD) оригинальному адалимумабу (Хумира®, Веттер Фарма-Фертигунг Гмбх и Ко.КГ, Германия) по эффективности, безопасности, фармакокинетике и иммуногенности. Также продемонстрировано отсутствие негативного влияния на описанные параметры переключения с оригинального препарата на биоаналог [28]. Весь спектр показаний к применению оригинального препарата был экстраполирован на биоаналог.
Заключение
Выход на рынок биоаналогов и их внедрение в клиническую практику позволяет существенно снизить затраты системы здравоохранения и обеспечить большее число пациентов эффективной терапией. Как правило, в течение 2-3 лет после выхода на рынок биоаналогов наблюдаются следующие тенденции: (1) снижение рыночной стоимости соответствующих МНН; (2) повышение доступности терапии для пациентов без дополнительной нагрузки на государственный бюджет; (3) замещение оригинальных препаратов в государственных закупках биоаналогами. В связи с увеличением частоты использования биоаналогов перед регуляторами встает вопрос о возможной взаимозаменяемости оригинальных препаратов и их копий. В Европейском союзе полномочия по решению этого вопроса переданы на национальный уровень. В настоящее время принято считать, что переключение с референтного препарата на его биоаналог является безопасным и эффективным. Более того, нет оснований предполагать другой кли нический исход при переключении между двумя биоаналогами. Обоснованность данного подхода подтверждается анализом опыта реальной клинической практики и национальных регистров.
Генно-инженерная биологическая терапия
Генно-инженерные биологические препараты (ГИБП) — инновационный способ лечения РА. Рассказываем, как эта терапия останавливает воспаление и развитие РА, но при этом не угнетает работу иммунитета целиком.

Генно-инженерные биологические препараты — это лекарственные препараты на основе белковых молекул, созданные с помощью методов генной инженерии и применяющиеся для лечения ревматоидного артрита. ГИБП точечно воздействуют на определенные звенья иммунной системы, отвечающие за патологические процессы, но при этом не тормозят работу всего иммунитета. Рассказываем, что такое ГИБП, как они работают и какие препараты используют сегодня для лечения ревматоидного артрита в России.
Что такое ГИБП
Клетки организма передают друг другу сигналы с помощью белков, которые называются цитокинами. Можно сказать, что цитокины — язык, на котором клетки разговаривают друг с другом. Чтобы цитокин мог передать сигнал клетке, он должен связаться со специфическими рецепторами на ее мембране. Если цитокин будет находиться возле клетки, но не свяжется с рецепторами, клетка не получит сигнал.
Цитокины, которые запускают реакции воспаления, называются провоспалительными цитокинами. Ключевыми провоспалительными цитокинами в развитии ревматоидного артрита являются интерлейкин-6 и ФНОα.
Генно-инженерные биологические препараты (ГИБП) блокируют сами цитокины или рецепторы, через которые цитокины связываются с клеткой. А также ингибируют патологическую активацию Т-лимфоцитов и В-лимфоцитов, которые участвуют в патогенезе ревматоидного артрита. В зависимости от механизма действия можно выделить 4 группы ГИБП:
- ингибиторы рецепторов к ИЛ-6 или самого ИЛ-6;
- ингибиторы ФНОα, или рецепторы, которые конкурентно связываются с ФНОα;
- антитела к CD20-рецептору на В-лимфоцитах;
- блокаторы ко-стимуляции (активации) Т-лимфоцитов.
Как получают ГИБП
При ревматоидном артрите иммунная система атакует собственные ткани организма. Такой патологический процесс представляет собой сложные реакции иммунной системы с участием разных иммунных клеток. Подавить патологическую активацию иммунитета можно несколькими способами. Один из них — это разрушить иммунные клетки. Другой способ — заблокировать те реакции, которые приводят к поддержанию хронического воспалительного процесса и нарушениям со стороны органов и тканей.
Это можно сделать с помощью сложных белковых молекул, которые получают методом генной инженерии из человеческих или животных клеток. Ученые программируют клетки, чтобы они производили нужные молекулы, которые обладают определенными терапевтическими свойствами [2].
Все ГИБП, которые используются в России для лечения ревматоидного артрита, —это терапевтические моноклональные антитела или рекомбинантные белки. Антитело — белковая молекула, которую организм производит в норме, чтобы обезвредить чужеродное вещество, например вирус или бактерию. Терапевтические антитела связываются с теми компонентами иммунной системы, которые отвечают за развитие заболевания и таким образом прерывают каскад патологических реакций. В статье про лечение мы подробно рассказали о том, как работают другие группы препаратов при ревматоидном артрите.
Как врач назначает ГИБП
Обычно врачи назначают ГИБП в комбинации с базисными противовоспалительными препаратами (БПВП) — это дает лучший лечебный эффект. Но, если пациент плохо переносит БПВП или у него есть противопоказания, врач может оставить только ГИБП для монотерапии — лечения одним препаратом [1, 9].
Каждое заболевание имеет свои особенности, а каждое лекарство — противопоказания. Поэтому только лечащий врач может правильно подобрать препарат, который будет эффективен для конкретного пациента.
В целом все ГИБП обладают сходным профилем безопасности. Во время лечения могут развиться нежелательные реакции в связи с иммуносупрессивным действием препаратов. Например, повышенный риск инфекций, подавление продукции клеток крови в костном мозге, аллергические реакции и т. д. Чтобы этого избежать, перед назначением ГИБП врач проводит пациенту ряд обследований [1]:
- общий и биохимический анализ крови, исследование крови на инфекции;
- скрининг на туберкулез (рентгенография или компьютерная томография органов грудной клетки, кожные пробы или анализы крови на туберкулез);
- а также другие обследования в соответствии с клинической ситуацией.
Комментарий эксперта: генно-инженерные биологические препараты
Ингибиторы рецепторов к ИЛ-6
Что происходит в организме: один из ключевых цитокинов, который вызывает воспаление при ревматоидном артрите, –—это интерлейкин-6 (ИЛ-6). Эффекты ИЛ-6 можно разделить на системные и локальные [3, 9,].
- Системные: стимуляция острофазового воспалительного ответа, при котором клетки печени усиленно синтезируют острофазовые белки воспаления. Например: С-реактивный белок (СРБ), фибриноген, сывороточный амилоидный белок А (SAA), гипсидин. Эти белки отвечают за развитие таких осложнений, как вторичный амилоидоз или анемия хронического заболевания. Также ИЛ-6 стимулирует выработку лептина — гормона, который играет важную роль в развитии анорексии при хронических воспалительных заболеваниях. К проявлениям системного действия ИЛ-6 можно отнести лихорадку и утреннюю скованность.
- Локальные: ИЛ-6 участвует в процессе разрушения суставов и развития синовита — воспаления синовиальной оболочки.
Рецепторы, через которые интерлейкин может передать сигнал в клетку, бывают двух типов:
- мембранные, которые находятся на поверхности мембран клеток. Не все клетки имеют этот рецептор;
- растворимые, которые свободно плавают в кровотоке. Связавшись с растворимым рецептором, ИЛ-6 сможет передать сигнал в клетку, которая не имеет мембранного рецептора.
Как действует препарат на основе ингибиторов рецепторов ИЛ-6: препараты из группы ингибиторов рецепторов к ИЛ-6 — это антитела, которые связываются и блокируют оба типа рецепторов: как мембранные, так и растворимые. В итоге ИЛ-6 остается в кровотоке, но уже не может связываться с другими клетками и передавать им сигнал.
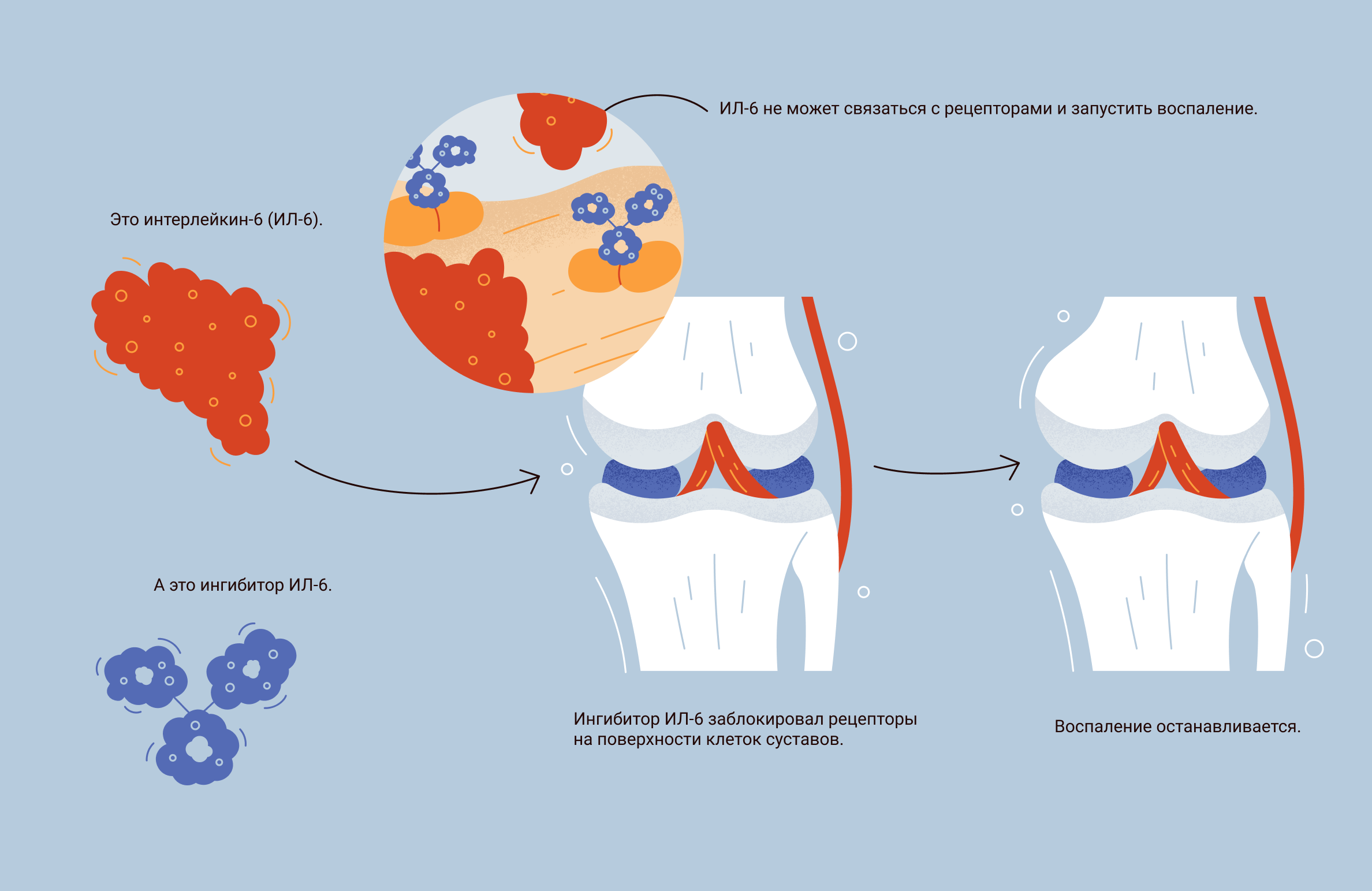
Какие препараты используют в РФ: для лечения РА используют три препарата, каждый из которых блокирует оба типа рецепторов к ИЛ-6:
- Тоцилизумаб — гуманизированное (максимально приближенное к человеческому) моноклональное антитело [1, 8].
- Сарилумаб — человеческое моноклональное антитело [1, 14].
- Левилимаб — высокогуманизированное (максимально приближенное к человеческому) моноклональное антитело [1, 13].
Ингибиторы ФНОα
Что происходит в организме: фактор некроза опухоли альфа (ФНОα) — еще один цитокин, который запускает воспалительную реакцию в организме после того, как свяжется с клеткой. В нормальных условиях такая реакция помогает победить инфекцию [5, 6]. Вот основные эффекты ФНОα в развитии ревматоидного артрита [3]:
- усиление синтеза веществ, запускающих реакцию воспаления и деструкцию суставов – — провоспалительных цитокинов, хемокинов, молекул адгезии, металлопротеиназ, коллагеназ и простагландинов;
- стимуляция ангиогенеза — образования новых кровеносных сосудов;
- увеличение выживаемости клеток соединительной ткани в синовиальной оболочке суставов — синовиальных фибробластов.
- повышение продукции фактора дифференцировки остеокластов — лиганда остеопротегерина (OPG) — RANKL. Это вещество, которое отвечает за разрушение костной ткани;
- усиление болей в суставах.
Как развивается ревматоидный артрит на клеточном и тканевом уровне
Объясняем на доступном языке, что такое провоспалительные цитокины, ревматоидный фактор, костно-фиброзный анкилоз. И как это связано с развитием ревматоидного артрита на уровне клеток и тканей.
Как действует препарат: ингибитор ФНОα — это антитело, которое связывается с молекулой ФНОα и блокирует ее. Заблокированный ФНОα не может связаться с клеткой и передать ей сигнал, а значит, не может запустить реакцию воспаления.
Какие препараты используют в РФ: для лечения ревматоидного артрита используют 5 молекул, ингибирующих ФНОα [1]:
- Инфликсимаб — химерное моноклональное антитело. Химерные антитела состоят из фрагментов разного происхождения. Так инфликсимаб примерно на 25% состоит из мышиных аминокислот и на 75% из человеческих аминокислот [9].
- Адалимумаб — человеческое моноклональное антитело [9];
- Голимумаб — человеческое моноклональное антитело [9];
- Цертолизумаба пэгол — гибридная молекула. Состоит из части антитела, которую ученые соединили с полимерным веществом —полиэтиленгликолем (ПЕГ). Благодаря этому цертолизумаба пэгол дольше находится в крови и дольше оказывает лечебный эффект [9].
- Этанерцепт — гибридная молекула. Состоит из части рецептора к ФНОα, которая соединена с фрагментом человеческого антитела. В отличие от других ингибиторов ФНОα, этанерцепт дополнительно нейтрализует лимфотоксин — еще одно вещество, вызывающее воспаление [9].
Анти-CD20 моноклональные антитела (Анти B-клеточная терапия)
Что происходит в организме: есть несколько типов иммунных клеток. Во время воспаления каждый из этих типов выполняет свои задачи. Например, у человека, болеющего ангиной, макрофаги захватывают и переваривают вредные бактерии, а тучные клетки выделяют гистамин — медиатор воспаления, который способствует развитию отека и воспаления. Лимфоциты — клетки иммунной системы, которые обеспечивают выработку антител, провоспалительных цитокинов, взаимодействие с другими клетками иммунной системы (регуляция их деятельности) и пораженными клетками, подлежащими удалению из организма. Один из типов таких иммунных клеток называется B-клетками или B-лимфоцитами. В норме, когда B-клетки сталкиваются с патогеном, например бактерией или вирусом, то начинают синтезировать против него антитела. Антитела связываются с патогеном, после чего другие иммунные клетки распознают и уничтожают этот комплекс.
При ревматоидном артрите определенные популяции B-лимфоцитов, участвующие в регуляции иммунного ответа, синтезируют широкий спектр аутоантител. Это антитела, которые атакуют собственные ткани организма. Также эти B-лимфоциты повышают синтез провоспалительных цитокинов, что приводит к повреждению тканей и активации Т-лимфоцитов. Активированные Т-лимфоциты поддерживают иммуновоспалительный процесс при РА [9].
Часть B-лимфоцитов содержит специфический белок CD20. Лекарственные препараты оказывают терапевтический эффект за счет того, что связываются с этим белком [4, 10].
Как действует препарат: молекула связывается с белком CD20 на поверхности B-клетки — это запускает ряд иммунных реакций, после которых клетка разрушается. Таким образом патологический процесс прерывается.
Препарат воздействует только на те В-лимфоциты, которые имеют рецептор CD20. Остальные В-лимфоциты не повреждаются и продолжают выполнять свои функции. Иммунная защита организма от инфекций полностью не блокируется.
Какие препараты используют в РФ:
- Ритуксимаб — химерное моноклональное антитело, которое состоит из человеческих и частично мышиных аминокислот [1, 9].
Блокатор ко-стимуляции Т-лимфоцитов
Что происходит в организме: Т-лимфоциты — еще один тип иммунных клеток, который управляет иммунным ответом. Т-лимфоциты бывают нескольких видов, каждый из которых выполняет свои функции. Вот как это работает:
- Эффекторные Т-лимфоциты (Т-хелперы и Т-киллеры) отвечают за иммунную защиту организма от инфекций. Т-хелперы активируют иммунную систему (В-клетки, моноциты) для синтеза антител, провоспалительных цитокинов и др. А Т-киллеры разрушают поврежденные клетки собственного организма.
- Регуляторные Т-лимфоциты сдерживают силу и продолжительность иммунного ответа через регуляцию активности Т-эффекторных клеток. Таким образом регуляторные Т-клетки поддерживают толерантность к собственным антигенам организма и предотвращают развитие иммуновоспалительных заболеваний [12].
При ревматоидном артрите баланс между эффекторными и регуляторными Т-лимфоцитами нарушается. Активных эффекторных Т-лимфоцитов, которые синтезируют провоспалительные цитокины и стимулируют B-лимфоциты вырабатывать аутоантитела, становится больше. Таким образом запускается иммуновоспалительный (аутоиммунный) процесс.
Чтобы Т-лимфоцит стал активным, он должен связаться с рецептором на клетке, которая передает сигнал. Если заблокировать этот рецептор с помощью лекарственного препарата, Т-лимфоцит не может получить сигнал от клетки — таким образом патологическая реакция не запускается [11].
Как действует препарат: связывает и блокирует ключевые белки на поверхности клеток, которые активируют Т-лимфоциты [9].
Ревматоидный артрит — симптомы и лечение
Что такое ревматоидный артрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Семизаровой Ирины Вячеславовны, ревматолога со стажем в 35 лет.
Над статьей доктора Семизаровой Ирины Вячеславовны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Ревматоидный артрит — это хроническое воспалительное заболевание соединительной ткани, которое характеризуется повреждением суставов и системным поражением внутренних органов.
Краткое содержание статьи — в видео:
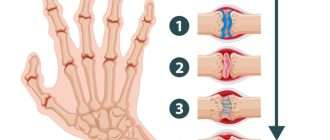
Чаще всего заболевание поражает именно суставы, но может также затрагивать другие системы (лёгкие, сердце и нервную систему). Повреждение суставов происходит вследствие хронического воспаления синовиальной оболочки — внутреннего слоя, выстилающего суставную сумку.
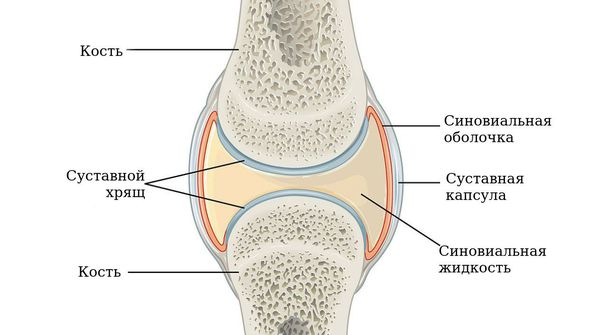
По мере прогрессирования болезни происходит эрозия кости и деформация суставов. Заболевание имеет аутоиммунный характер, это означает, что в организме образуются антитела против собственных тканей. В результате длительного воздействия этих антител происходит разрушение и воспаление тканей.
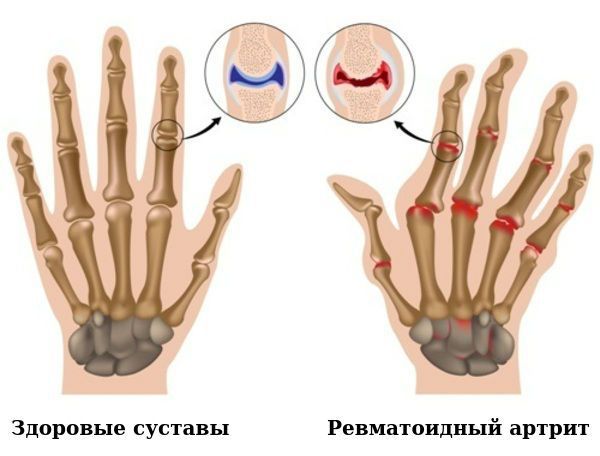
Причины развития ревматоидного артрита неизвестны.
Предрасполагающие факторы:
- Инфекции (вирус Эпштейна — Барр, парвовирус В19 и др.).
- Генетические факторы, носительство антигена гистосовместимости HLA-DR4.
- Курение, злоупотребление кофе, высокий индекс массы тела, стресс.
- Контакт с минеральными маслами (моторными или гидравлическими). В эксперименте [13] было показано, что эти масла обладают артритогенными (т. е. вызывающими воспаление суставов ) свойствами.
- Половые гормоны и факторы репродукции (беременность, роды и т. д.).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы ревматоидного артрита
В течении ревматоидного артрита выделяют продромальный период, который формируется за несколько недель и/или месяцев до развития типичного симптомокомплекса, присущего ревматоидному артриту. Он проявляется общей слабостью, недомоганием, болями в мышцах и суставах, снижением аппетита, субфебрильной температурой (от 37,1 до 38 °C) [1] [2] [8] .
Дебют ревматоидного артрита может клинически проявляться различными вариантами:
- неспецифическими признаками с незначительно выраженным суставным проявлением (умеренные боли в суставах);
- острым полиартритом (боль, отёчность двух или трёх суставов, ограничение объёма движений в них) с преимущественным поражением суставов кистей, стоп, выраженной утренней скованностью;
- острым полиартритом с системными проявлениями: фебрильная лихорадка (температура от 38 до 39 °C); лимфаденопатия (увеличение лимфоузлов; могут увеличиться до размера грецкого ореха); гепатоспленомегалия (увеличение печени и селезёнки) [1] .
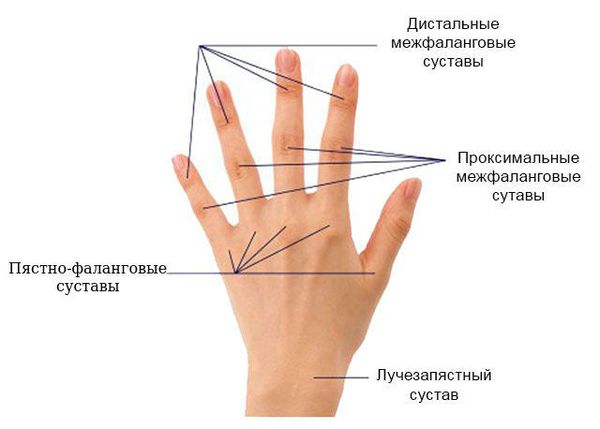
Для ранней стадии РА характерно поражение второго и третьего проксимальных межфаланговых и пястно-фаланговых суставов, а также положительный симптом сжатия кисти или стопы (при сжатии кисти или стопы возникает резкая боль) на уровне пястно-фаланговых и плюснефаланговых суставов. Типичным симптомом РА является веретенообразная дефигурация (изменение формы сустава, например в виде лебединой шеи или пуговичной петли) проксимальных межфланговых суставов кистей.
Одним из наиболее ранних и характерных симптомов является утренняя скованность (пациент не может согнуть и разогнуть суставы, как будто руки в тугих перчатках). Выраженность скованности чётко взаимосвязана с воспалительной активностью. При высокой активности воспалительного процесса она длится на протяжении многих часов, однако по утрам особенно выражена и всегда снижается после двигательной активности.
В развёрнутой и финальной стадиях заболевания появляются типичные для РА деструкции, деформации и анкилозы (заращение сустава, отсутствие движений в нём).
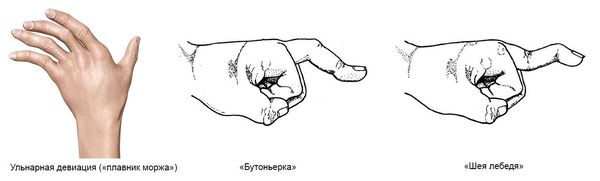
- ульнарная девиация пястно-фаланговых суставов (пальцы отклоняются в локтевую сторону в виде плавников моржа), обычно через 1-5 лет от начала болезни;
- поражение пальцев кистей по типу «бутоньерки» (сгибание в проксимальном межфаланговом суставе) или «шеи лебедя» (переразгибание в проксимальном межфаланговом суставе);
- деформация кисти по типу «лорнетки» [1][5] .
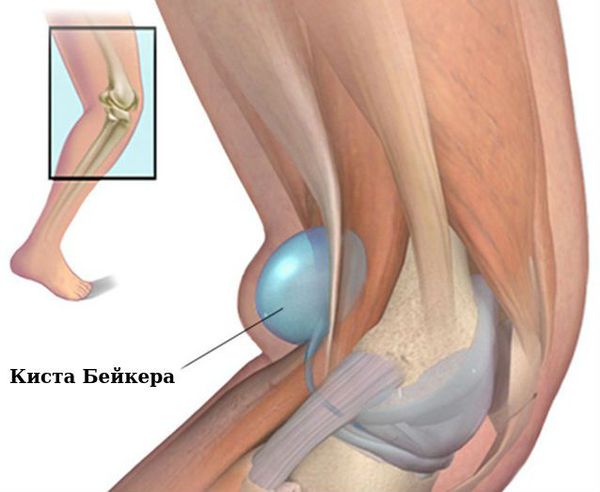
Коленные суставы: сгибательная и вальгусная (колени сводятся внутрь) деформация, киста Бейкера (подколенная или коленная киста).
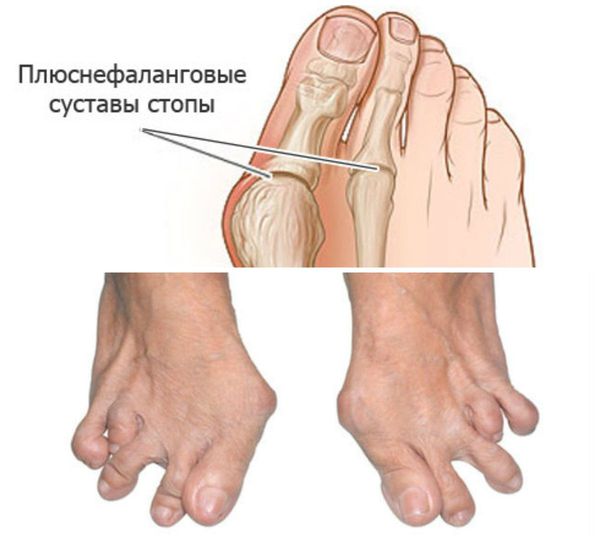
Стопы: подвывихи головок плюснефаланговых суставов, латеральная девиация (отклонение большого пальца к другим пальцам стопы), деформация большого пальца.
Шейный отдел позвоночника: подвывихи в области атлантоаксиального сустава, иногда осложняющиеся сдавлением спинного мозга или позвоночной артерии.
Перстневидно-черпаловидный сустав: огрубение голоса, одышка, дисфагия (пациент не может глотать), рецидивирующий бронхит.
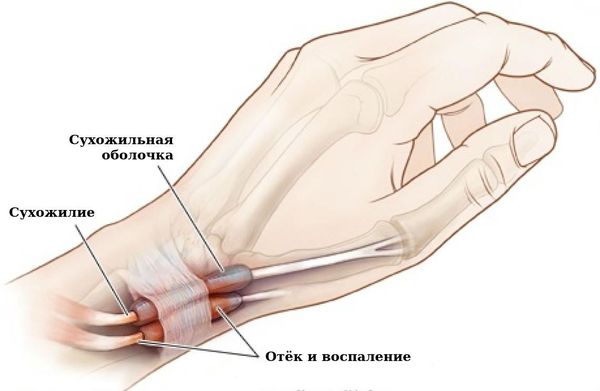
Связочный аппарат и синовиальные сумки: теносиновит (воспаление оболочек сухожилия) в области кисти и лучезапястного сустава; бурсит (воспаление в синовиальной сумке), чаще в области локтевого сустава; синовиальная киста на задней стороне коленного сустава (киста Бейкера).
Для РА характерны разнообразные внесуставные и системные проявления.
Конституциональные симптомы: генерализованная слабость, недомогание, похудение вплоть до истощения (вес меньше 40 кг), субфебрильная лихорадка.
В полиморфной картине ревматоидного артрита поражение сердца встречается нечасто. Кардиальная симптоматика может быть обусловлена как непосредственно воспалительным процессом в сердце, так и осложнением РА — атеросклерозом. При этом заболевании возможно вовлечение в патологический процесс миокарда (самой толстой мышцы сердца), перикарда (внешней оболочки сердца), эндокарда (внутренней оболочки сердца), аорты и венечных артерий сердца. Встречаются такие заболевания, как перикардит (воспаление внешней оболочки сердца), гранулематозное поражение клапанов сердца (очень редко), раннее развитие атеросклероза, воспаление коронарных артерий [1] [6] .
При РА нередко встречается поражение лёгких. Оно проявляется:
- плевритом (воспалением плевральных листков);
- интерстициальными поражениями лёгких (воспалением и нарушением структуры альвеолярных стенок, лёгочных капилляров);
- облитерирующим (обструктивным) бронхиолитом (стойкой, прогрессирующей закупоркой мелких бронхов);
- ревматоидными узелками в лёгких (синдром Каплана).
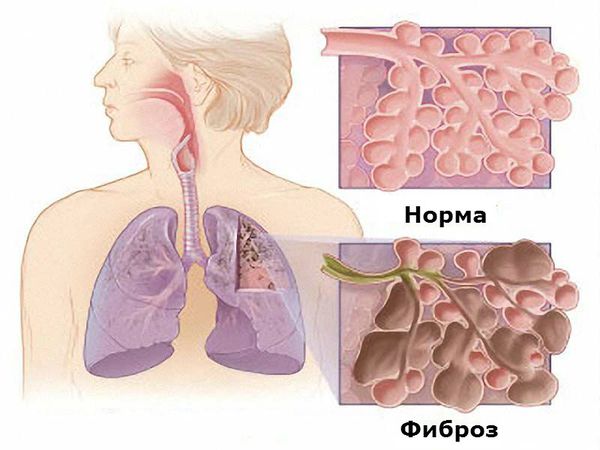
Наиболее серьёзным проявлением поражения лёгких является фиброзирующий альвеолит, который обусловлен как самим заболеванием, так и применением некоторых базисных противовоспалительных препаратов, а именно метотрексата, препаратов золота и Д-пеницилламина [1] [6] [7] . Фиброзирующий альвеолит проявляется непродуктивным кашлем (сухим, без мокроты), одышкой экспираторного типа (затруднён выдох), серым цианозом. Он приводит к повышению давления в лёгочной артерии и развитию лёгочного сердца (увеличению правых отделов сердца). На рентгенограмме определяется усиление лёгочного рисунка, феномен «медовых сот» (деструктивное изменение лёгких, характеризуется содержанием многочисленных кистозных воздушных пространств с толстыми стенками).
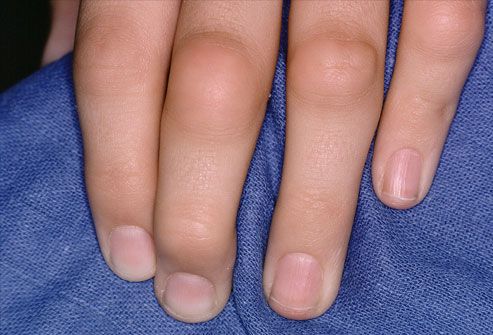
Кожный синдром имеет множество проявлений. Типичным внесуставным признаком являются ревматоидные узелки (костные образования на суставах размером с горошину или грецкий орех), которые располагаются под кожей чаще всего на разгибательной поверхности локтевых суставов, при атипичном расположении могут появляться на ахилловом сухожилии, роговице, в сухожилиях.
Кожными проявлениями ревматоидного артрита считают и развитие различных патологий:
- кожного васкулита (воспаления сосудов кожи) от язвенно-некротических изменений до утолщения и гипотрофии кожи;
- дигитального (пальцевого) артериита ( воспаления и разрушения подкожных сосудов ), редко с гангреной пальцев;
- микроинфарктов в области ногтевого ложа (нарушения кровообращения, закупорки сосуда микротромбом и появления чёрных точек на пальцах),
- сетчатого ливедо (р етикулярной асфиксии, или Livedo reticularis) — нежного рисунка синего цвета в виде кружева [8] .
Поражения периферической нервной системы объясняются сдавлением нервных стволов или их сосудистым поражением. Для ревматоидного артрита характерны компрессионные нейропатии: синдром запястного канала (длительная боль, онемение пальцев кисти), тарзального канала (боль в области голеностопного сустава, чувство ползания мурашек по руке) и т. д. Компрессия нервных стволов проявляется болями, чувством ползания мурашек, онемением, регионарной атрофией мышц. Возможно и поражение периферических нервов, которое проявляется чувствительными или чувствительно-двигательными нарушениями.
Большое значение при ревматоидном артрите имеет поражение мышц: атрофия межкостных мышц кисти, тенора (возвышения большого пальца), гипотенора (возвышения мизинца). Характерна атрофия мышц, которые расположены близко к поражённым суставам, например атрофия межкостных мышц кистей, мышц нижней трети бедра в случае выраженного артрита коленных суставов. Амиотрофия (отсутствие мышц) может быть проявлением ревматоидного васкулита, нейропатии, например при синдроме запястного или локтевого канала, длительном применении глюкокортикоидов, ограничении мышечной активности [1] [2] [8] .
Патология глаз является одним из характерных проявлений ревматоидного артрита. Часто возникает эписклерит (воспаление тканей глаза), который очень редко сопровождается тяжёлым течением или исходом в перфорирующую склеромаляцию (размягчение ткани) с образованием отверстий в роговице и энуклеацией (удалением ядра).
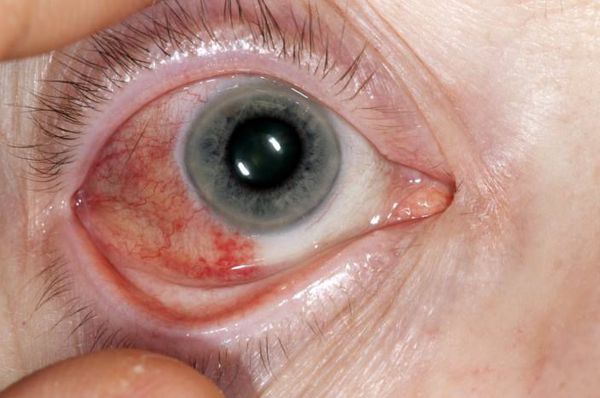
При склерите (воспалении склеры глаза) и склерокератите (воспалении склеры и роговицы глаза) появляется выраженная боль и покраснение склеры. Характерен для этого заболевания и синдром сухого глаза, который является следствием скопления лимфоцитов в слёзных железах и обычно рассматривается в рамках синдрома Шегрена.
Патология почек проявляется диффузным гломерулонефритом (поражением клубочкового аппарата почек), распространённым амилоидозом (скоплением белка амилоида) с преимущественным поражением почек или лекарственной нефропатией (повреждением ткани и клубочкового аппарата почек). Последняя обусловлена приёмом нестероидных противовоспалительных средств (НПВС), например диклофенака, или комбинированных анальгетиков с фенацетином, что приводит к развитию интерстициального нефрита (воспаления в межуточной ткани почек).
Система крови реагирует на аутоиммунный воспалительный процесс развитием анемии, тромбоцитоза (увеличения содержания в крови тромбоцитов), нейтропении (снижения количества нейтрофилов). Возможны также вторичные, лекарственно обусловленные осложнения:
- в ответ на приём цитостатиков в виде панцитопении (снижения уровня всех видов кровяных клеток);
- на фоне высоких доз глюкокортикостероидов в виде лейкемоидной реакции (увеличения общего количества лейкоцитов).
Система макрофагов часто реагирует на активный воспалительный процесс развитием лимфаденопатии (увеличения лимфатических узлов), спленомегалии (увеличения селезёнки), формированием особой формы ревматоидного артрита в виде синдрома Фелти [2] [7] .
Поражение желудочно-кишечного тракта (ЖКТ) может быть представлено вторичным амилоидозом, аутоиммунным гепатитом, но наиболее часто выявляется эрозивное поражение вследствие приёма НПВС или глюкокортикостероидов.
У пациентов с высокой активностью ревматоидного артрита может развиваться васкулит:
- дигитальный артериит;
- пальпируемая пурпура (геморрагическая сыпь),
- ретикулярная асфиксия (пурпурный сетчатый сосудистый рисунок на коже);
- периферическая полинейропатия;
- висцеральный артериит: коронариит (воспалительное поражение стенок сосудов, питающих миокард), мезентериальный тромбоз (закупорка сосудов ткани, с помощью которой кишечник крепится к брюшной стенке), инфаркт кишечника, острый пневмонит, альвеолит);
- синдром Рейно (онемение и болевой синдром пальцев рук).
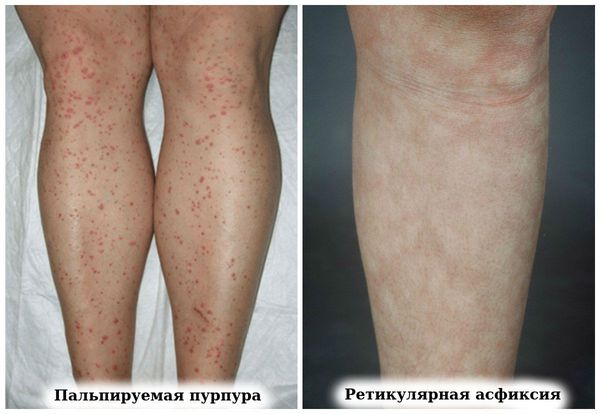
Эндокринные проявления — в связи с аутоиммунным характером заболевания одновременно могут развиваться аутоиммунный тиреоидит (хроническое заболевание щитовидной железы, при котором происходит постепенное разрушение клеток), синдром Шегрена.
Выделяют также редкие особые клинические формы течения ревматоидного артрита:
Синдром Фелти характеризуется таким симптомокомплексом: нейтропения, спленомегалия, гепатомегалия, тяжёлое поражение суставов, внесуставные проявления (васкулит, нейропатия, лёгочный фиброз, синдром Шегрена), гиперпигментация кожи нижних конечностей, высокий риск инфекционных осложнений. Этот синдром развивается у больных с длительным течением РА.
Болезнь Стилла у взрослых — рецидивирующая фебрильная лихорадка, артрит, макулопапулезная сыпь, высокая лабораторная активность. Он одинаково часто встречается у мужчин и женщин. Для этого синдрома характерна истощающая лихорадка, которая нередко достигает температуры выше 41 °C. Лихорадка носит стойкий характер и парадоксально реагирует на проводимую терапию. Поражение суставов характеризуется доброкачественным течением. При синдроме Стилла наблюдаются лейкоцитоз со сдвигом формулы влево, повышение активности печёночных ферментов, анемия, диспротеинемия (сдвиг белкового состава плазмы крови), ускоренная скорость оседания эритроцитов (СОЭ), повышение С-реактивного белка, который отражает острые воспалительные процессы в организме, гиперферритинемия (повышенный ферритин в крови) [1] [8] .
Патогенез ревматоидного артрита
В норме синовиальная оболочка имеет толщину всего несколько клеток, она вырабатывает синовиальную жидкость, которая смазывает и питает сустав. Механизм развития ревматоидного артрита можно представить следующим образом.
- Ревматоидный артрит приводит к тому, что иммунные клетки атакуют здоровую синовиальную оболочку. Развивается субсиновиальный отёк, в синовиальной оболочке скапливаются лимфоциты, полиморфно-ядерные лейкоциты, моноциты и плазматические клетки.
- При этом иммунные клетки выделяют защитные белки — цитокины, которые провоцируют разрастание кровеносных сосудов синовиальной оболочки.
- Повышенный кровоток приводит к избыточному росту ткани. Синовиальные клетки быстро размножаются, что приводит к утолщению синовиальной ткани. Такая патологически утолщённая ткань называется «паннус».
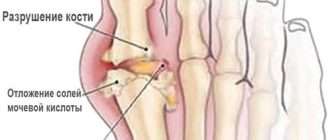
- Клетки паннуса выделяют протеолитические ферменты, которые разрушают хрящ.
- Одновременно под воздействием гиперпродукции провоспалительных цитокинов (ФНО-альфа и др.) происходит активация остеокластов (клеток костной ткани, которые уничтожают старую структуру), что ведёт к повреждению костей. В дальнейшем происходит разрушение костной ткани с образованием эрозий.
- Костные эрозивные изменения происходят ещё и в результате активации фибробластов (главных клеток рыхлой соединительной ткани), которые начинают вырабатывать ферменты, способные разрушать суставной хрящ [1][2] .
- Прогрессирование заболевания приводит к тому, что паннус превращается в зрелую фиброзную ткань, что ведёт к сращению суставных поверхностей.
Классификация и стадии развития ревматоидного артрита
Международная классификация болезней 10-го пересмотрм (МКБ-10):
- М05 — Серопозитивный ревматоидный артрит.
- М06 — Другие ревматоидные артриты.
- М05.0 — Синдром Фелти.
- М06.1 — Болезнь Стилла у взрослых.
- М06.9 — Ревматоидный артрит неуточнённый.
Рабочая классификация ревматоидного артрита (проект 2002):
Серопозитивный ревматоидный артрит (М 05).
- Полиартрит (М05).
- Ревматоидный васкулит (М 05.2) (дигитальный артериит, хронические язвы кожи, синдром Рейно и др.).
- Ревматоидные узлы (М 05.3).
- Полинейропатия (М 05.3).
- Ревматоидная болезнь лёгких (М 05.1) (альвеолит, ревматоидные лёгкие).
- Синдром Фелти (М 05.1).
Серонегативный ревматоидный артрит (М 06.0).
- Полиартрит (М 06.0).
- Синдром Стилла взрослых (М 06.1) [14] .
В течение длительного времени для установления достоверного диагноза РА использовались критерии 1987 года.
Пересмотренные диагностические критерии РА (ARA 1987):
- Утренняя скованность (не менее 1 часа).
- Артрит трёх или более суставных зон.
- Артрит суставов кистей.
- Симметричный артрит.
- Ревматоидные узелки.
- Ревматоидный фактор.
- Рентгенологические изменения.
Достоверный диагноз РА устанавливают при наличии четырёх из семи вышеперечисленных критериев, причём первые четыре должны существовать не менее шести недель.
В настоящее время доказана возможность изменения отрицательного прогноза РА в случае раннего начала патогенетической базисной терапии. Поэтому длительное время разрабатывались методы ранней диагностики РА. В 2010 году ассоциацией американских и европейских ревматологов были приняты критерии ранней диагностики РА, в которых клинические и лабораторные показатели выражены в баллах. При суммарной величине более 6 баллов может быть установлен достоверный диагноз ранней стадии РА, что предполагает возможность начала патогенетической терапии базисными препаратами [1] [2] [6] .
Наличие 6 из 10 баллов указывает на определённый РА.
В 2007 году Ассоциации ревматологов России приняла новую классификацию РА, включающую несколько разделов.
Основной диагноз:
- Ревматоидный артрит серопозитивный (М05.8).
- Ревматоидный артрит серонегативный (М06.0).
- Особые клинические формы ревматоидного артрита:
- синдром Фелти (М05.0);
- болезнь Стилла, развившаяся у взрослых (М06.1).
- Ревматоидный артрит вероятный (М05.9, М06.4, М06.9).
Клиническая стадия:
- Очень ранняя стадия: длится меньше 6 месяцев.
- Ранняя стадия: длится от 6 месяцев до года.
- Развёрнутая стадия: длится больше года при наличии типичной симптоматики ревматоидного артрита.
- Поздняя стадия: длится 2 года и более, протекает с выраженным повреждением мелких (III-IV рентгенологическая стадия) и крупных суставов, наличие осложнений.
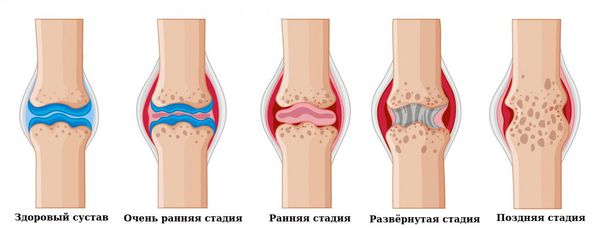
Активность болезни:
- 0 = ремиссия: DAS28 < 2,6 (DAS28 — индекс активности болезни).
- 1 = низкая: 2,6 < DAS28
- 2 = средняя: DAS28 = 3,2-5,1.
- 3 = высокая (DAS28 > 5,1).
Внесуставные (системные) проявления:
- Ревматоидные узелки.
- Кожный васкулит (язвенно-некротический васкулит, инфаркты ногтевого ложа, дигитальный артериит, ливедо-ангиит).
- Васкулит других органов.
- Нейропатия (мононеврит, полинейропатия).
- Плеврит (сухой, выпотной), перикардит (сухой, выпотной).
- Синдром Шегрена.
- Поражение глаз (склерит, эписклерит, васкулит сетчатки).
Инструментальная характеристика:
- Наличие эрозий (с использованием рентгенографии, возможно МРТ, УЗИ):
- неэрозивный;
- эрозивный.
- Рентгенологическая стадия (по Штейнброкеру, модификация):
- I — околосуставной остеопороз.
- II — остеопороз + сужение суставной щели, возможны единичные эрозии.
- III — признаки предыдущей стадии + множественные эрозии + подвывихи в суставах.
- IV — признаки предыдущей стадии + костный анкилоз.
Дополнительная иммунологическая характеристика — антитела к циклическому цитрулинированному пептиду (АЦЦП). Цитруллинированный пептид — это белок, который вырабатывается в результате обменных процессов в организме. В норме цитруллин полностью выводится из организма. При развитии РА концентрация ЦЦП повышается, иммунная система воспринимает его как чужеродный и начинает вырабатывать к нему антитела.
- АЦЦП — присутствуют (+);
- АЦЦП — отсутствуют (-).
Функциональный класс:
- I — пациент выполняет все три жизненно-важные функции: самообслуживание, профессиональные и непрофессиональные обязанности.
- II — пациент ограничен только в непрофессиональной деятельности (все элементы досуга, отдых, развлечения, занятия спортом).
- III — ограничена непрофессиональная и профессиональная деятельность (работа и учёба, ведение домашнего хозяйства), но сохранена возможность самообслуживания.
- V — утрачены все три жизненно-важные функции, даже возможность самообслуживания [14] .
Осложнения ревматоидного артрита
- Амилоидоз почек возможен при длительном течении ревматоидного артрита. Проявляется отёками, повышением артериального давления, большим количеством белка в анализах мочи. Т. е. за сутки теряется 3-20 г белка. Диагноз может быть подтверждён биопсией почки.
- Остеонекроз — омертвение участка кости, вызванное нарушением кровоснабжения. Появляется сильная боль в поражённом суставе, ограничение объёма движений в нём. Для подтверждения диагноза необходимо сделать рентгенографию, компьютерную томографию сустава.
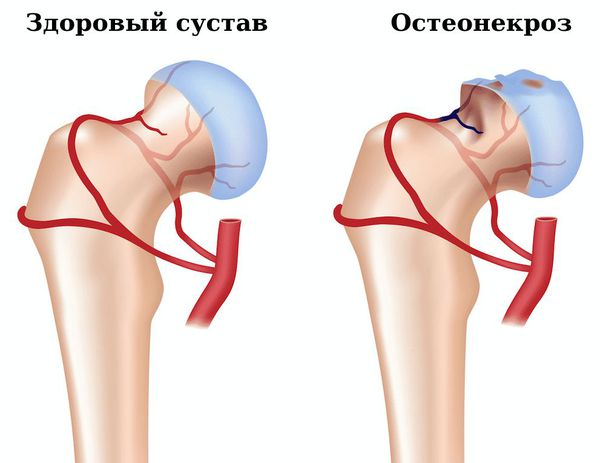
- Вторичный остеоартроз — появление болей в суставе, хруст при движении в нём, может быть отёчность. Для подтверждения диагноза надо сделать рентген сустава.
- Туннельные синдромы — неврологическое заболевание, проявляющиеся длительной болью и онемением пальцев кисти. Причиной заболевания является сдавление срединного нерва между костями, поперечной кистевой связкой и сухожилиями мышц запястья.
- Кардиоваскулярные проявления — для пациентов с ревматоидным артритом характерно раннее развитие атеросклероза. Поэтому возможно возникновения инсульта и инфаркта [12] .
- Медикаментозные ятрогении (токсические и аллергические) — это патологические состояния, вызванные медицинским вмешательством. Т. е. под влиянием медицинских воздействий могут возникнуть новые заболевания у пациента, либо осложнение, либо ухудшение уже имеющегося заболевания.
Также к осложнениям относятся рак желудочно-кишечного тракта, остеопороз, синдром Сикки, синдром Фелти, лимфома и др. [12] .
Диагностика ревматоидного артрита
Лабораторные исследования, рекомендуемые для обследования пациентов с подозрением на ревматоидный артрит [2] :
- Общий анализ крови с подсчётом количества тромбоцитов.
- Биохимический анализ крови (общий белок, альбумин, глобулиновые фракции, общий билирубин, мочевина, креатинин, электролиты, кальций, холестерин, липидный спектр крови, С-реактивный белок, ревматоидный фактор).
- Исследование уровня антител к циклическому цитруллинированному пептиду (АЦЦП).
- Общий анализ мочи, определение белка в моче.
- Исследование сывороточных иммуноглобулинов
Ранняя диагностика подразумевает исследование уровня АЦЦП:
- АЦЦП — обязательно выполняется для ранней диагностики ревматоидного артрита, т. к. является более чувствительным и специфичным серологическим маркером раннего ревматоидного артрита, чем ревматоидный фактор (РФ). (РФ — белки, которые вырабатываются иммунной системой человека и атакуют собственные клетки, ошибочно воспринимая их как чужеродные.)
- АЦЦП выявляются у 40-50 % больных ревматоидным артритом с отрицательным РФ.
- АЦЦП «+» является показанием к началу антиревматической терапии на ранней стадии (менее шести месяцев), что позволяет эффективно затормозить прогрессирующее поражение суставов.
- АЦЦП «+» значимо для дифференциальной диагностики и прогнозирования течения ревматоидного артрита.
Инструментальные методы диагностики, рекомендуемые для обследования пациентов с подозрением на ревматоидный артрит:
- рентгенография суставов;
- УЗИ суставов;
- МРТ суставов;
- артроскопия;
- диагностическая пункция сустава: иммунологическое, цитологическое исследование, бактериальный посев синовиальной жидкости.
Дифференциальный диагноз следует проводить со следующими заболеваниями: остеоартроз, системная красная волчанка, подагра, псориатический артрит, анкилозирующий спондилит, реактивный артрит, бактериальный эндокардит, септический артрит, вирусные артриты, системная склеродермия, идиопатические воспалительные миопатии, смешанное заболевание соединительной ткани, болезнь Лайма, амилоидоз, саркоидоз, рецидивирующий полихондрит, фибромиалгия.
Лечение ревматоидного артрита
Цели: уменьшение или устранение симптомов артрита и внесуставных проявлений, контроль над воспалительной активностью, предотвращение прогрессирования костно-суставной деструкции, сохранение и существенное улучшение качества жизни, увеличение продолжительности жизни до среднего уровня в популяции [3] [5] [10] .
Treat to Target (T2T) — лечение до достижения цели (рекомендации EULAR)
Общие рекомендации:
- Исключение стрессов.
- Исключение чрезмерного облучения солнечной радиацией. Интенсивное солнце тоже провоцирует развитие ревматических заболеваний.
- Активное лечение сопутствующих инфекций, при необходимости вакцинация.
- Профилактика атеросклероза: употребление пищи с малым содержанием жира, холестерина и высоким содержанием полиненасыщенных жирных кислот, отказ от курения, контроль массы тела, физические упражнения, приём фолиевой кислоты.
- Профилактика остеопороза: пища с высоким содержанием кальция, приём витамина Д, возможно назначение бисфосфонатов.
Медикаментозное лечение
Базисная терапия ревматоидного артрита
БПВП — базисные противовоспалительные препараты (синонимы: базисные препараты, болезнь-модифицирующие антиревматические препараты, медленно действующие препараты) — главный компонент лечения РА, при отсутствии противопоказаний они должны быть назначены каждому пациенту с этим диагнозом. Особенно важно назначение БПВП сразу после установления диагноза на ранней стадии, когда имеется ограниченный период времени (несколько месяцев) для достижения наилучших отдалённых результатов — так называемое «терапевтическое окно» [9] [10] .
Метотрексат — один из основных препаратов терапии РА. Цитотоксический препарат из группы антиметаболитов. По структуре аналог фолиевой кислоты. Каждому пациенту с РА при отсутствии явных противопоказаний должна быть назначена терапия метотрексатом.
Метотрексат является препаратом выбора при активном ревматоидном артрите, как на ранней, так и в развёрнутой и поздней стадиях. Этот препарат обладает значительной терапевтической широтой и возможностью индивидуального подбора дозировок, эффективные дозы находятся в диапазоне 15-30 мг/нед, в среднем — 20 мг/нед.
Метотрексат достаточно безопасен, требует минимального лабораторного контроля (общий анализ крови и трансаминазы), целесообразно назначение фолиевой кислоты 3-5 мг/сут в дни без введения препарата [5] [11] . Применяют внутрь, подкожно и внутримышечно.
Основные нежелательные явления: М-эрозивный стоматит, эрозивный гастрит, диспепсия, геморрагический энтероколит, гепатоцеллюлярный синдром, нефротоксичность, обструктивная мочекислая нефропатия.
Лефлуномид («Арава») — антивоспалительное, иммуномодулирующее, антипролиферативное действие. Специально был разработан для лечения РА.
Нежелательные явления: желудочно-кишечная токсичность, печёночная токсичность, кожная сыпь, алопеция, цитопении, фиброзирующий альвеолит, снижение веса, лихорадка, почечная токсичность — при их развитии необходим приём холестирамина по 8 г три раза в день в течение 11 дней [5] [10] [11] .
Биологическая терапия РА
Введение ГИБП (генно-инженерных биологических препаратов) стало главным прорывом в лечении ревматических заболеваний. ГИПБ представляют собой искусственные антитела (белки из группы иммуноглобулинов). С появлением биологических препаратов появилась возможность достичь длительной и стойкой ремиссии у больных с ревматоидным артритом. В настоящее время ГИБП разделены на группы по их механизму действия:
- препараты, направленные на подавление продукции ФНО-альфа (фактора некроза опухоли): инфликсимаб, этанерцепт, адалимумаб, цертолизумаб пегол, голимумаб [1][5][8] .
- ингибиторы иммуноглобулинов: ИЛ-1, ИЛ-6.
- абатацепт — растворимый белок, направленный на подавление ко-стимуляции Т-клеток,
- препараты, блокирующие действие В-клеток (ритуксимаб и белимумаб), применяются при ревматоидном артрите и системной красной волчанке.
В последнее время в лечении серонегативных спондилоартритов, включая псориатический артрит, широко используются устекинумаб (блокатор ИЛ-1223) и секукинумаб (ингибитор ИЛ-17) [8] [9] .
Побочные эффекты. Биологические препараты помимо положительных свойств обладают и отрицательными:
- Снижение противоинфекционного и (потенциально) противоопухолевого иммунитета. Общими для всех антагонистов ФНО-альфа нежелательными побочными реакциями (НПР) является повышение восприимчивости к инфекциям, включая возможность обострения гистоплазмоза (грибкового заболевания) и гепатита В. Появляется риск развития демиенилизирующих заболеваний, волчаночноподобного синдрома (лекарственной волчанки, которая возникает в результате приёма медикаментозных препаратов), злокачественных новообразований, тромбоэмболии (закупорки кровеносного сосуда тромбом), реакции гиперчувствительности. Среди наиболее частых НПР фигурируют назофарингит (воспаление слизистой оболочки носоглотки), инфекции мочевых и верхних дыхательных путей, боль в животе, диарея, появление АНФ (антинуклеарного фактора, который показывает наличие или отсутствие аутоиммунного заболевания) и антител к двуспиральной ДНК. Особенно возрастает восприимчивость организма к туберкулёзу. При применении антагонистов ФНО-альфа туберкулёз может давать атипичную клиническую картину. Учитывая это, до начала терапии ГИБП все пациенты должны быть обследованы на предмет как активной так и латентной туберкулёзной инфекции: проба Манту, Диаскин-тест [3][6] .
- Риск развития аллергических реакций и иммуногенность, т. е. реакция собственной иммунной системы на ГИБП, которые содержат чужеродный мышиный белок. Вырабатываемые при этом нейтрализующие антитела к ГИБП снижают эффективность проводимой терапии и способствуют развитию инфузионныхпостинъекционных реакций. Чаще всего эти антитела образуются к инфликсимабу, содержащему больше мышиного компонента, чем гуманизированные анти-ФНО-альфа препараты. Частота их появления при РА составляет от 7 до 53 % в зависимости от дозы. Назначение инфликсимаба в комбинации с метотрексатом снижает вероятность образования антител. При лечении этанерцептом и адалимумабоб антитела выявляются реже (5-17 %). При применении адалимумаба в комбинациии с метотрексатом частота возникновения антител минимальна и составляет около 1 % [1][4][6] .
Действие антагонистов ФНО альфа вызывает небольшое, но длительно сохраняющееся увеличение содержания холестерина ЛПВП (так называемый «хороший» холестерин). Которое, в свою очередь, может оказать благоприятный эффект на сердечно-сосудистые риски у пациентов с хроническим артритом. Доказано снижение частоты сердечно-сосудистой патологии и летальности в группе больных РА, получавших лечение анти-ФНО-альфа препаратами, по сравнению с пациентами, в комплексной терапии которых данная группа препаратов не использовалась. С другой стороны, следует иметь в виду, что у больных РА с застойной сердечной недостаточностью антагонисты ФНО-альфа должны применяться с особой осторожностью. Поскольку они способны приводить к декомпенсации кровообращения и увеличению летальности. Выраженная хроническая сердечная недостаточность является противопоказанием для назначения ГИБП [4] [9] .
Класс малых молекул
Тофацитиниб («Яквинус») — препарат нового класса для терапии РА. Он может использоваться как в качестве монотерапии, так и в сочетании с метотрексатом или другими БПВП вне зависимости от приёма пищи [4] [6] .
Симптоматическая терапия
НПВП — нестероидные противовоспалительные препараты. Их особенность — быстрое наступление терапевтического эффекта, активное подавление боли и воспаления (диклофенак, «Нимесил», «Найз», «Аркоксия» и др.)
ГКС — глюкокортикостероиды. Применяются в следующих случаях:
- при максимальной активности воспалительного процесса;
- при интенсивных болях, не купирующихся НПВП;
- при генерализованном артрите с экссудативными проявлениями;
- при системных проявлениях РА;
- как компонент bridge-терапии («Метипред», преднизолон, «Полькортолон»)
Локальная терапия ГКС — внутрисуставно и периартикулярно: бетаметазона дипропионат-дипроспан; триамцинолона ацетонид («Кеналог»); гидрокортизон ацетат.
Немедикаментозное лечение
Несмотря на то, что медикаментозная терапия является главным компонентом лечения РА, немедикаментозные методы играют важную роль в достижении полноценного лечебного эффекта. Цель реабилитационных мероприятий — восстановление нарушенных или утраченных способностей пациента, его адаптация к хроническому заболеванию [3] .
Лечебная физкультура и трудотерапия (специальные упражнения, имитирующие движения в процессе самообслуживания, направленные на восстановление моторики) полезны больным РА.
Физиотерапия и бальнеотерапия полезны пациентам с низкой активностью воспаления, они могут заметно уменьшить симптоматику и улучшить подвижность [3] .
Прогноз. Профилактика
Прогноз
Показатели смертности у больных РА увеличиваются: средняя продолжительность жизни снижается на 8-15 лет. Около 40 % пациентов в течение трёх лет становятся нетрудоспособными. Примерно у 80 % в течение 20 лет развивается нетрудоспособность средней и тяжёлой степени и в 25 % случаев требуется обширное протезирование суставов.
Факторы неблагоприятного прогноза: женский пол, положительный РФ, поражение плюснефаланговых суставов в начале заболевания.
РА является дорогостоящим заболеванием. Это связано как со стоимостью медицинских расходов, так и со снижением работоспособности больного вплоть до её полной потери. Особенно высоки прямые и непрямые затраты при неэффективности лечения [5] [7] . Однако современные методы лечения, особенно комбинированная терапия активными синтетическими и биологическими противовоспалительными препаратами, могут снизить краткосрочные и долгосрочные затраты на лечение тяжёлого РА. Эти данные следует учитывать при рассмотрении плана лечения конкретного больного.
Профилактика
Этиология РА неизвестна, первичная профилактика не проводится [1] . Скрининг не проводится.
Ревматоидный артрит — тяжёлое заболевание, которое меняет жизнь человека. Многие пациенты впадают в отчаяние и думают, что так тяжело будет всегда. Но это не так. Важно лечиться, выполнять назначения врача, не бояться информации о своей болезни. Нужно уметь расслабляться, соблюдать режим, не стесняться делиться своими эмоциями, страхами, переживаниями, наблюдениями. Нужно всегда помнить, что душевное равновесие, внутреннее спокойствие и позитивный настрой — лучшие союзники в борьбе с болезнью [3] .
Важно иметь в виду, что предварительные результаты свидетельствуют о выявлении иммунологических нарушений (увеличение титров РФ, анти-ЦБ, и СРБ) за несколько месяцев или лет до появления клинических симптомов РА [1] .
Источник https://clinpharm-journal.ru/articles/2019-4/bioanalogi-v-lechenii-revmaticheskih-boleznej-pro-et-contra/
Источник https://revmo.info/treatment/genno-inzhenernaya-biologicheskaya-terapiya
Источник https://probolezny.ru/artrit-revmatoidnyy/