Болезнь Вильсона-Коновалова
Болезнь Вильсона-Коновалова (гепатоцеребральная дистрофия, гепатолентикулярная дегенерация) — это генетическое расстройство, не позволяющая организму удалять лишнюю медь, вызывая накопление меди в печени, головном мозге, глазах и других органах.
Для поддержания здоровья организму требуется небольшое количество меди из пищи, но большое количество меди вредно. Без лечения болезнь Вильсона может привести к высокому содержанию меди, что может привести к опасному для жизни повреждению органов.
Насколько распространена болезнь?
Эксперты все еще изучают, насколько распространена болезнь Вильсона. Более старые исследования показали, что больны примерно 1 из 30 000 человек. Эти исследования были проведены до того, как ученные обнаружили мутации генов, вызывающих заболевание.
Более новые исследования генов пациентов предполагают, что заболевание может быть более распространенной. Исследование, проведенное в Великобритании, показало, что примерно у 1 из 7000 человек есть генетические мутации, вызывающие болезнь Вильсона.
Эксперты не уверены, почему генные исследования предполагают, что заболевание встречается чаще, чем считалось ранее. Одной из причин может быть то, что некоторым больным пациентом не ставили диагнозы. Другая причина может заключаться в том, что некоторые пациенты имеют мутации генов, но заболевание по какой-то причине не развивается.
Причины болезни Вильсона-Коновалова
Как известно, болезнь Вильсона вызывают мутации гена под названием ATP7B. Эти мутации генов не позволяют организму удалить лишнюю медь из организма. Обычно печень выделяет лишнюю медь в желчь. Медь вместе с другими токсичными веществами и отходами выводится из организма через желудочно-кишечный тракт. При заболевании печень выделяет меньше меди в желчь, соответственно, в организме её остается больше.
Мутации ATP7B, вызывающие заболевание, наследуются, т.е., передаются от родителей ребенку. Мутация является аутосомно-рецессивной, что означает, что ребенок должен унаследовать две мутировавшие копии гена ATP7B, по одному от каждого родителя, чтобы заболеть. Люди, имеющие один ген ATP7B без мутации и один ген ATP7B с мутацией, обычно не страдают заболеванием, а являются её носителями.
Людям может быть присуща болезнь, если оба родителя являются носителями, не страдающими от неё сами. На приведенной ниже диаграмме показана вероятность наследования заболевания от родителей, которые являются носителями.

Мутации, вызывающие болезнь Вильсона, являются аутосомно-рецессивными, что означает, что человек должен унаследовать две копии гена с мутациями, чтобы заболеть.
Симптомы болезни Вильсона
Симптомы болезни Вильсона многообразны. Состояние присутствует при рождении, но симптомы не проявятся, пока не накопиться слишком много меди в печени, головном мозге или других органах.
Некоторые пациенты не испытывают признаков и симптомов гепатоцеребральной дистрофии до постановления диагноза и лечения. Однако, если симптомы присутствуют, они связаны с печенью, нервной системой и психическим здоровьем, глазами или другими органами.
Печеночные симптомы

У людей с болезнью Вильсона могут развиться признаки гепатита или воспаление печени. В некоторых случаях эти симптомы у больных появляются, когда возникает острая печеночная недостаточность.Симптомы включают:
- чувство усталости;
- тошнота и рвота;
- отсутствие аппетита;
- боль над печенью, в верхней части живота;
- потемнение цвета мочи;
- светловатый цвет стула;
- желтоватый оттенок склер глаз и кожи (желтуха)
Некоторые люди с заболеванием имеют симптомы только в том случае, если у них развивается хроническая болезнь печени и осложнения, вызванные циррозом печени. Эти симптомы могут включать:
- чувство усталости или слабости;
- беспричинное похудение;
- вздутие живота от скопления жидкости в животе (асцит);
- отек голеней, лодыжек или ступней;
- зуд кожи;
- желтуху.
Признаки со стороны нервной системы и психического здоровья
У пациентов с заболеванием могут развиться проблемы с нервной системой и психическим здоровьем. Эти проблемы чаще встречаются у взрослых, но иногда появляются и у детей. Симптомы нервной системы могут включать:
- проблемы с речью, глотанием или физической координацией;
- скованность мышц;
- тремор или неконтролируемые движения.
Симптомы психического здоровья могут включать:
- тревогу;
- изменения в настроении, личности или поведении;
- депрессию;
- психоз.
Глазные симптомы

Многие люди с болезнью Вильсона имеют кольца Кайзера-Флейшера, представляющие собой кольца зеленоватого, золотого или коричневатого цвета по краям роговицы. Кольца появляется в результате накопление меди в глазах. Так просто их не заметить, обычно врач-офтальмолог обнаруживает кольца во время специального обследования глаз, называемого осмотром щелевой лампой.
Среди пациентов с проблемами нервной системы при болезни Вильсона-Коновалова более 9 из 10 имеют кольца Кайзера-Флейшера, а среди больных, испытывающих проблемы с печенью, только 5-6 из 10 имеют кольца Кайзера-Флейшера.
Другие симптомы и проблемы со здоровьем
Гепатоцеребральная дистрофия может повлиять и на другие части тела, вызывая симптомы или проблемы со здоровьем, в том числе:
- тип анемии, называемой гемолитическая анемия;
- проблемы с костями и суставами, например, артрит или остеопороз;
- проблемы с сердцем, например, кардиомиопатия;
- проблемы с почками (ацидоз почечных канальцев и нефролитиаз).
У больных с гепатоцеребральной дистрофией симптомы обычно появляются в возрасте от 5 до 40 лет. Однако у некоторых пациентов признаки проявляются в более молодом или старшем возрасте. Врачи обнаружили первые симптомы болезни Вильсона у детей в возрасте 9 месяцев и у взрослых старше 70 лет.
Диагностика

Болезнь диагностируют на основании медицинской и семейной истории, физического осмотра, осмотра глаз и анализов.
Врачи обычно используют анализ крови и 24-часовой анализ мочи для диагностики болезни Вильсона. Специалисты также проводят биопсию печени и визуализационные исследования.
Медицинская и семейная история.
Врач спросит о семье и личной истории болезни Вильсона и других состояниях, вызывающих симптомы.
Во время медицинского осмотра врач проверит признаки повреждения печени, например:
- изменения кожи;
- увеличение селезенки или печени;
- припухлость на животе;
- отек в нижней части ног, ступней или лодыжек;
- желтоватый цвет белых глаз.
Обследование глаз проводиться щелевой лампой. Во время обследования щелевой лампой врач использует специальный свет для поиска колец Кайзера-Флейшера в глазах.
Для анализа крови медицинский работник возьмет образец крови и отправит ее в лабораторию.
Специалист может заказать один или несколько анализов крови, включая анализы, проверяющие количество:
- церулоплазмина, белка, несущего медь в крови. Люди с болезнью Вильсона часто имеют низкий уровень церулоплазмина, но не всегда.
- меди. У пациентов с заболеванием уровень меди в крови может быть ниже нормы. Острая печеночная недостаточность из-за болезни Вильсона приводит к повышению уровня меди в крови.
- аланинатрансаминаза (АЛТ) и аспартататрансаминаза (АСТ). Больные с гепатоцеребральной дистрофией могут иметь ненормальные уровни АЛТ и АСТ.
- эритроцитов для поиска признаков анемии.
Врачи также могут заказать анализ крови на наличие мутаций гена, вызывающих болезнь, если другие медицинские анализы не помогут подтвердить или исключить диагноз заболевания.
24-часовой анализ мочи.
В течение 24 часов пациент должен будет собирать свою мочу в домашних условиях в специальный контейнер, предоставив ее потом медицинским работникам. Медицинский работник отправит мочу в лабораторию, которая проверит количество меди в моче. Уровень меди в моче у пациентов с болезнью Вильсона-Коновалова часто выше нормы.
Если результаты анализов крови и мочи не подтверждают или не исключают диагноз заболевания, врач назначит биопсию печени. Во время биопсии врач извлечет небольшие кусочки ткани из печени, а патологоанатом исследует ткань под микроскопом, чтобы найти особенности конкретных заболеваний печени, такие как болезнь Вильсона, и проверит наличии повреждений и цирроза печени. Кусочек ткани печени будет отправлен в лабораторию, которая проверит количество меди в ткани.
Визуализационные методы исследования.
При проблемах с нервной системой врачи могут заказать визуальные тесты для выявления признаков болезни Вильсона или других состояний мозга.
- Магнитно-резонансная томография (МРТ), которая использует радиоволны и магниты для получения детальных изображений органов и мягких тканей без использования рентгеновских лучей.
- Компьютерная томография (КТ), которая использует комбинацию рентгеновских лучей и компьютерных технологий для создания детальных изображений.
Лечение болезни Вильсона-Коновалова
Лечат заболевание при помощи:
- лекарств, удаляющих медь из организма, называемых хелатирующими агентами;
- цинка, препятствующего поглощению меди кишечником.
Во многих случаях лечение улучшает или предотвращает симптомы и повреждения органов. Врачи также могут порекомендовать изменить диету, чтобы избежать употребления продуктов с высоким содержанием меди.
Люди с болезнью Вильсона-Коновалова нуждаются в пожизненном лечении. Прекращение терапии может привести к острой печеночной недостаточности. Медицинские работники регулярно будут проводить анализы крови и мочи, чтобы проверять, как протекает лечение.
Хелатирующие агенты
Пеницилламин (Купрамин, Депен) и Триентин (Сиприн) являются двумя хелатирующими агентами, используемыми для лечения болезни Вильсона. Лекарства удаляют медь из организма.
Пеницилламин чаще вызывает побочные эффекты, чем триентин. Побочные эффекты пеницилламина могут включать лихорадку, сыпь, проблемы с почками или проблемы с костным мозгом. Пеницилламин также снижает активность витамина В6, поэтому врачи могут порекомендовать принимать добавку витамина В6 вместе с пеницилламином. В некоторых случаях, когда пациенты с симптомами нервной системы начинают принимать хелатирующие агенты, их симптомы усиливаются.
Когда начинается лечение, врачи постепенно увеличивают дозу хелатирующих агентов. Больные принимают более высокие дозы хелатирующих агентов, пока лишняя медь из организма не будет удалена. Когда симптомы болезни Вильсона улучшатся, и анализы покажут, что содержание меди на безопасном уровне, могут назначить более низкие дозы хелатирующих агентов в качестве поддерживающей терапии. Препараты этой группы применяются с перерывами в течение всей жизни.
Хелатирующие агенты могут мешать заживлению ран, поэтому, на момент операции врачи могут назначать более низкие дозы препарата.
Цинка предотвращает поглощение меди кишечником. Врачи могут назначить цинк в качестве поддерживающей терапии, после того, как хелатообразующие агенты удалят лишнюю медь из организма. Также цинк может назначаться людям, у которых болезнь Вильсона-Коновалова обнаружена, но протекает бессимптомно.
Наиболее распространенным побочным эффектом цинка является расстройство желудка.
Прекращение приема лекарств от болезни может вызвать быстрое накопление меди и опасные для жизни последствия. Важно, чтобы пациенты, принимающие ацетат цинка, использовали рецептурную версию этого препарата, потому что пищевые добавки не могут быть биоэквивалентными и могут быть неэффективными.
Питание

Во время лечения, врач может порекомендовать избегать продуктов с высоким содержанием меди, например:
- шоколад;
- печень;
- грибы;
- орешки;
- моллюск.
После того, как лечение понизило уровень меди и началась поддерживающая терапия, поговорите с врачом о том, можно ли безопасно есть умеренное количество этих продуктов.
Если водопроводная вода поступает из колодца или течет по медным трубам, проверьте уровень меди в воде. Вода, проходящая в медных трубах, может содержать медь. Возможно, придется использовать фильтры для воды, чтобы удалить медь из водопроводной воды.
Из соображений безопасности поговорите с врачом перед использованием пищевых добавок, витаминов, или любых дополнительных или альтернативных лекарств. Некоторые пищевые добавки могут содержать медь.
Как лечат болезнь Вильсона беременным женщинам?
Беременные женщины должны продолжать лечение болезни на протяжении всей беременности. Врачи назначат более низкие дозы хелатирующих препаратов. Поскольку плод нуждается в небольшом количестве меди, снижение дозы может удерживать медь на безопасном уровне без удаления слишком большого количества.
В большинстве случаев врачи рекомендуют женщинам продолжать принимать полную дозу цинка во время беременности. Эксперты рекомендуют женщинам с болезнью Вильсона не кормить грудью, если принимают хелатирующие препараты. Пеницилламин присутствует в грудном молоке и может быть вредным для ребенка. О безопасности триентина и цинка, содержащегося в грудном молоке имеется мало информации.
Как лечат осложнения болезни?
Если заболевание приводит к циррозу, врачи лечат проблему и осложнения, связанные с циррозом, с помощью лекарств, операции и других медицинских процедур.
Если болезнь вызывает острую печеночную недостаточность или печеночную недостаточность вследствие цирроза, может потребоваться пересадка печени. Пересадка печени избавляет от заболевания в большинстве случаев.
Профилактика
Предотвратить заболевание нельзя. Если есть родственник первой степени — родитель, брат, сестра — с болезнью Вильсона-Коновалова, поговорите с врачами об обследовании вас и других членов семьи на предмет заболевания. Врач может поставить диагноз и начать лечение до появления симптомов и осложнений.
Ранняя диагностика и лечение могут уменьшить или предотвратить повреждение органов.
Прогноз
Прогноз улучшается при назначении адекватной терапии на ранних стадиях заболевания. Терапия на поздней стадии существенно не влияет на развитие и прогрессирование осложнений и на прогноз заболевания. Смерть наступает преимущественно в молодом возрасте, как правило, от осложнений цирроза печени (кровотечение из варикозно расширенных вен пищевода и желудка, печеночная недостаточность, фульминантная печеночно-клеточная недостаточность), реже — от осложнений, связанных с поражением нервной системы.
Трансплантация печени
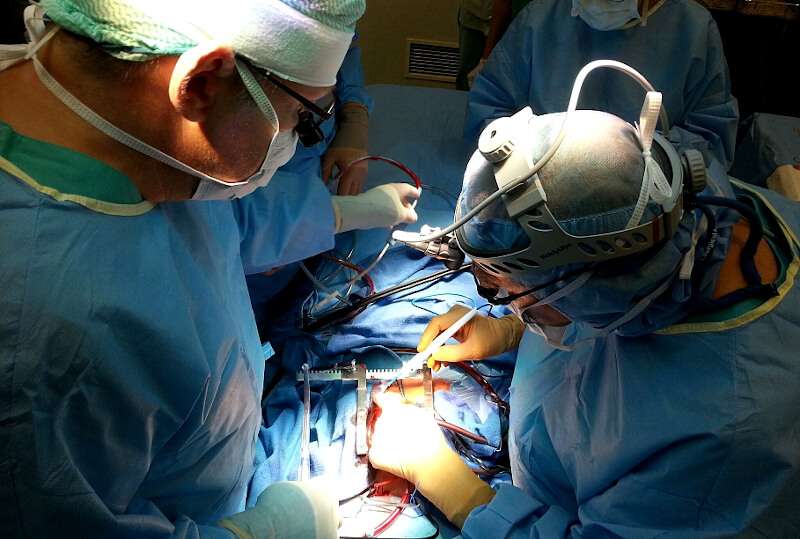
В данной статье речь пойдёт о трансплантации печени: правовые аспекты трансплантации печени в РФ, показания к операции, подготовка к оперативному лечению, виды доноров, оперативное вмешательство у пациентов, особенности ведения реципиентов после операции.
Каждому человеку нужна здоровая печень для осуществления нормальной жизнедеятельности. Печень выполняет ряд жизненно важных функций в организме: она обеспечивает синтез глюкозы, белков, жиров, витаминов, выработку желчных кислот и холестирина, она отвечает за образования ряда факторов свёртывающей и противосвёртывающей систем организма. Также печень служит своего рода «фильтром» — она обеспечивает обезвреживание различных чужеродных веществ, в том числе аллергенов и токсинов. Если хотя бы одна из этих функций будет серьёзно нарушена, это может стать жизнеугрожающей ситуацией для организма.
Симптомы и синдромы заболевания печени:
- Желтуха — пожелтение кожи, и видимых слизистых оболочек;
- Потемнение мочи (цвет тёмного чая или тёмного пива);
- Обесцвечивание кала;
- Желудочно-кишечные кровотечения (рвота кровью, рвота чёрными массами, чёрный стул или кровь в стуле);
- Зуд;
- Асцит — скопление жидкости в животе;
- Склонность к кровоточивости слизистых носа, дёсен и т.д.;
- Энцефалопатия — нарушения памяти, забывчивость, спутанность сознания и подобные неврологические нарушения.
Помимо всего прочего, печеночная недостаточность даёт осложнения на другие органы и системы, что в итоге может привести к нарушению работы почек, лёгких, что в комплексе очень сильно ухудшает тяжесть состояния пациентов и требует дополнительного более сложного лечения.
При развитии печеночной недостаточности в исходе различных заболеваний, часто единственным методом лечения становится трансплантация печени.
Кто нуждается в трансплантации печени?
Трансплантация печени является наиболее эффективным и, часто, единственным радикальным методом лечения больных с терминальной стадией хронических диффузных болезней печени (цирроз, фиброз и пр.), фульминантной печеночной недостаточностью, злокачественными и доброкачественными опухолями печени.
В трансплантации печени нуждаются пациенты со следующими заболеваниями:
- Цирроз печени в исходе вирусных гепатитов B, C и D;
- Аутоиммунный гепатит;
- Токсический гепатит;
- Криптогенный цирроз печени (цирроз печени неуточнённой этиологии);
- Билиарный цирроз печени;
- Первичный склерозирующий холангит (ПСХ);
- Болезнь Кароли;
- Алкогольный цирроз печени (цирроз Лаэннека) — при условии 6-месячной алкогольной ремиссии;
- Острая печеночная недостаточность;
- Опухоли печени;
- Нейроэндокринные опухоли;
- Гепатоцеллюлярная карцинома (ГЦК);
- Гемангиоэндотелиома;
- Метастазы гастроинтестинальной стромальной опухоли (при условии медленного роста);
- Цирроз печени в исходе дефицита альфа-1-антитрипсина;
- Муковисцидоз; (статья по теме — трансплантация печени при муковисцидозе);
- Семейная гиперхолестеринемия;
- Гемохроматоз;
- Болезнь Вильсона-Коновалова;
- Болезни накопления гликогена
- Синдром Бадда-Киари;
- Синдром Клиглера-Найяра;
- Поликистоз печени;
- Синдром Алажиля; ;
- Саркоидоз;
- Обширная травма печени, ведущая к печеночной недостаточности.
Противопоказания к трансплантации печени.
После того как были исчерпаны возможности консервативного лечения и установлена необходимость трансплантации печени требуется ответить на 3 основных вопроса:
- Сможет ли пациент перенести операцию и ранний послеоперационный период;
- Будет ли пациент привержен к терапии и режиму необходимому для выживания после трансплантации печени;
- Есть ли у пациента сопутствующие заболевания, которые могут скомпрометировать его выживание или функцию трансплантата.
Абсолютные противопоказания:
- СПИД;
- внепечёночное распространение злокачественных опухолей;
- активная внепеченочная инфекция (туберкулез и другие);
- активный алкоголизм и наркомания;
- психические заболевания, исключающие регулярный прием иммунодепрессантов;
Относительные противопоказания:
- высокий кардиологический или анестезиологический риск;
- распространенный тромбоз воротной вены (статья по теме — трансплантация печени у пациентов с тромбозом воротной вены);
- ранее перенесенные вмешательства на печени;
- возраст более 60 лет;
- индекс массы тела (ИМТ) более 35 кг/м2.
Виды органного донорства.
В качестве потенциальных доноров рассматриваются как посмертные доноры, так и живые родственные доноры.
Трансплантация печени от посмертного донора.
Печень для трансплантации изымается только у посмертных доноров, перенесших смерть головного мозга (с сохранённым кровообращением и поддерживаемым аппаратным дыханием). Обстоятельства смерти и личности умерших доноров остаются конфиденциальными. Изъятие органов и (или) тканей не допускается, если установлено, что они принадлежат лицу, страдающему болезнью, представляющей опасность для жизни и здоровья реципиента. Подробнее здесь и здесь. Выполняют ортотопическую трансплантацию печени (целого органа), так и SPLIT-трансплантацию (донорская печени разделяется на две части и каждая часть пересаживается отдельному реципиенту).
Трансплантация печени от живого донора.
В Российской Федерации, как и во многих других странах, в целях трансплантации печени широко распространено использование фрагментов печени взрослых доноров. Этот вид трансплантологической помощи обладает рядом преимуществ – хорошее качество трансплантата, возможность проведения операции в необходимые сроки, и как правило, тканевая совместимость с донором. Такой вид трансплантации в нашей стране наиболее часто выполняют детям (трансплантация левого латерального сектора печени, трансплантация правой или левой доли печени).
Правовые аспекты родственного органного донорства в РФ.
По законам Российской Федерации, трансплантация печени (как и почки) от живого донора может быть произведена только в том случае, если потенциальный донор является биологическим родственником реципиента. Это могут быть ближайшие родственники — мать или отец, а так же более отдалённые — тётки, дяди, сёстры и братья. Стоит отметить, что супруги не являются кровными родственниками. Также, если реципиент является усыновлённым ребенком, его усыновители не могут быть донорами для него, в отличие от его биологических родителей. К донорству нельзя принуждать. Изъятие органов и (или) тканей не допускается, если установлено, что они принадлежат лицу, страдающему болезнью, представляющей опасность для жизни и здоровья реципиента. Изъятие органов и (или) тканей для трансплантации у лиц, находящихся в служебной или иной зависимости от реципиента, не допускается. Подробнее здесь и здесь.
Обследование живого родственного донора.
В качестве живого родственного донора обследуется кровный родственник реципиента старше 18 лет. В первоначальной беседе врач выявляет первичные противопоказания к донорству — проводит сбор анамнеза (выясняет у пациента подробно о перенесенных заболеваниях, наличии аллергических реакций, проводит измерение роста и веса, проводит психоэмоциональную оценку потенциального донора).
Далее проводится комплекс лабораторно-диагностического обследования, который включает в себя:
- Определение группы крови и резус-фактора;
- Клинический анализ крови с подсчётом лейкоцитарной формулы;
- Общий анализ мочи;
- Биохимический анализ крови;
- КЩС и электролитный статус;
- HLA-типирование и перекрестная лимфоцитотоксическая проба;
- Обзорная рентгенография органов грудной клетки;
- Электрокардиография;
- УЗИ сердца (ЭХО-КГ);
- Эзофагогастродуоденоскопия;
- Исследование функции внешнего дыхания (по показаниям);
- Ультразвуковая допплерография нижних конечностей.
Также, особенно важным аспектом обследования родственного донора является дооперационная оценка печени. Для этого выполняются УЗИ органов брюшной полости, мультиспиральная компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием. При индексе массы тела потенциального донора печени боле 25,0 баллов, выполняется пункционная биопсия печени.
Трансплантация печени (оперативное лечение).
Собственно оперативное вмешательства начинается с двухстороннего субкостального разреза, дополненного срединным разрезом до мечевидного отростка. При выполнении доступа требуется соблюдение тщательного гемостаза, ввиду наличия обширной развитой сети подкожных вен. Хирургическое вмешательство у реципиента включает в себя следующие этапы:
- Гепатэктомия;
- Наложение сосудистых анастомозов (в следующей последовательности – кавальная, портальная, артериальная реконструкция);
- Гемостаз и формирование желчеотводящего анастомоза.
Удаление пораженной печени в большинстве случаев представляет собой наиболее трудоемкий этап. В случае опухолевых поражений печени это связано с выраженной гепатомегалией. В случаях же цирроза, несмотря на значительное уменьшение размеров печени, гепатэктомия усложняется наличием венозных коллатералей в связках печени и ее воротах, наличием спаек, а также изменением обычных топографо-анатомических отношений в верхнем отделе брюшной полости и, нарушениями свертывающей системы крови.
Рассечение связочного аппарата начинают с круглой и серповидной связок. Затем пересекаются левая треугольная и левая венечная связки. Следующей составляющей этапа гепатэктомии является диссекция печеночно- двенадцатиперстной связки, при этом выделение воротной вены и печеночной артерии предусматривает полное освобождение от околососудистой ткани, тогда как при выделении желчного протока скелетирование последнего нежелательно.
Доступ к элементам печеночно-двеннадцатиперстной связки может быть крайне сложен. Изоляции элементов могут мешать увеличенные лимфатические узлы, содержащие множественные венозные и лимфатические коллатерали, спайки после перенесенных оперативных вмешательств. Общий желчный проток с окружающей клетчаткой пересекается. Собственная печеночная артерия выделяется до паренхимы. Она или ее долевые ветви должны быть лигированы как можно дистальнее. Проксимально артерия мобилизуется до желудочно- двеннадцатиперстной с выделением последней и взятием на держалку. Воротная вена склелетируется с подведением турникета.
После мобилизации элементов печеночно-двеннадцатиперстной связки рассекают правую венечную связку и мобилизуют правую долю печени. Данная манипуляция в условиях выраженного фиброза, развития венозных коллатералей, в особенности при уменьшении размеров печени представляет значительные трудности и нередко осложняется диффузным кровотечением из паренхимы печени. После описанных манипуляций становится доступной позадипеченочный отдел НПВ.
Дальнейшие действия зависят от избранной техники имплантации печени «классической» или Piggyback.
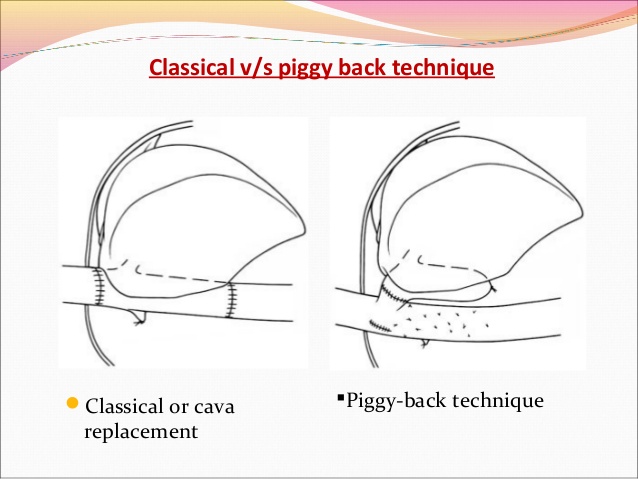
Техника классической трансплантации печени и техника Piggy-back.
Классическая техника ортотопической трансплантации печени.
Позадипеченочный отдел нижней полой вены мобилизуется на всем протяжении ретрокавального пространства: от почечный вен до диафрагмы. Ключевым моментом является выделение и пересечение правой надпочечниковой вены, впадающей непосредственно в нижнюю полую вену. После подготовки нижней полой вены пережимается воротная и полая вены (проксимально и дистально), выполняется гепатэктомия. Формируются анастомозы нижней полой вены донорской печени и реципиента проксимально и дистально и анастомоз воротной вены. Для поддержания гемодинамики традиционно использовалось обходное вено-венозное шунтирование. Для этого до гепатэктомии канюлируется воротная вена, предварительно подготовленные левая бедренная и подмышечная вены. Кровь от нижней половины тела и органов брюшной полости с помощью насоса направляется в верхнюю полую вену. Обходное вено-венозное шунтирование может применяться на начальных этапах освоения трансплантации печени.
Техника Piggyback.
Данный вариант подразумевает сохранение кровотока по нижней полой вене, отделение печени от позадипеченочного отдела НПВ. Пересечение связки НПВ по является ключевым моментом мобилизации позадипеченочного отдела НПВ, особенно в той ситуации, когда гипертрофированная хвостатая доля (I сегмент) окружает НПВ. Все мелкие печеночные вены, дренирующие хвостатую долю, и добавочные правые печеночные вены раздельно лигируются и пересекаются по направлению снизу вверх до уровня основных печеночных вен Таким образом, нижняя полая вена реципиента сохраняется на всем протяжении. Производится пережатие печеночных вен и воротной вены. Выполняется гепатэктомия без пережатия нижней полой вены. Устья печеночных вен объединяются, формируется анастомоз с надпеченочным отделом НПВ донорской печени. Подпеченочный отдел НПВ трансплантата ушивается. В некоторых случаях правая печеночная вена расположена каудально, что делает невозможным вовлечение ее в шов. В этом случае последнюю обходят циркулярно и пересекают между двумя зажимами, затем ушивают стороны НПВ непрерывным швом нитью / . В то же время пересечение правой печеночной вены позволяет отвести печень влево и провести безопасную изоляцию средней и левой печеночных вен.
Методика Piggyback c формированием анастомоза по типу «бок в бок».
Вариантом методики Piggyback, предложенным Belghiti является формирование анастомоза по типу «бок в бок» между ретропеченочным отделом НПВ реципиента и трансплантата. Производят предварительную подготовку НПВ трансплантата: ушиваются проксимальный и дистальный отдел полой вены донорской печени. После продольного частично пережатия полой вены реципиента максимально широко рассекается ее передняя стенка. Соответственно этому рассекается задняя стенка НПВ трансплантата, выполняется формирование анастомоза. В течение кавальной реконструкции трансплантат перфузируется мл или 1 раствора альбумина. Приступают к анастомозу воротной вены, которая предварительно максимально укорачивается. После окончания портального анастомоза снимаются зажимы с нижней полой и воротной вен, начинается реперфузия трансплантата. Кровотечение по линии анастомозов останавливается дополнительными швами. Артериальный анастомоз может быть выполнен в различных вариантах, в зависимости от состояния сосудов донора и реципиента, а также предпочтений хирурга. Наиболее часто артерия трансплантата на уровне чревного ствола анастомозируется с артерией реципиента на уровне гастродуоденальной артерии. В некоторых случаях использование артерии реципиента для анастомоза не представляется возможным (малый диаметр, доминирующая правая печеночная артерия из системы верхней брыжеечной артерии, изменения стенки сосуда после эндоваскулярных вмешательств). В этом случае может быть использована селезеночная артерия трансплантата. Альтернативным вариантом является использование подвздошных сосудов донора или сосудистого протеза и анастомоз с инфраренальным отделом аорты. Имплантация печени завершается билиарной реконструкцией. Наиболее предпочтительна холедохо-холедохостомия без дренирования. При невозможности использования собственного протока следует выполнить холедохоеюностомию. Операция завершается тщательным гемостазом и дренированием брюшной полости.
Хирургическая техника родственной ортотопической трансплантации левого латерального сектора печени.
Донорский этап.
Донору выполняется левосторонняя латеральная секторэктомия. На основании принципов хирургии живых родственных доноров и необходимости получить жизнеспособный трансплантат с приемлемым анатомическим вариантом кровоснабжения и желчеоттока, основными задачами при операции у донора являются:
- минимизация кровопотери при сохранённом кровоснабжении печени в период разделения паренхимы;
- сокращение времени тепловой ишемии трансплантата;
- получение пригодных для последующей реконструкции участков сосудов (левой печ ночной вены, левой ветви воротной вены и левой печёночной артерии).
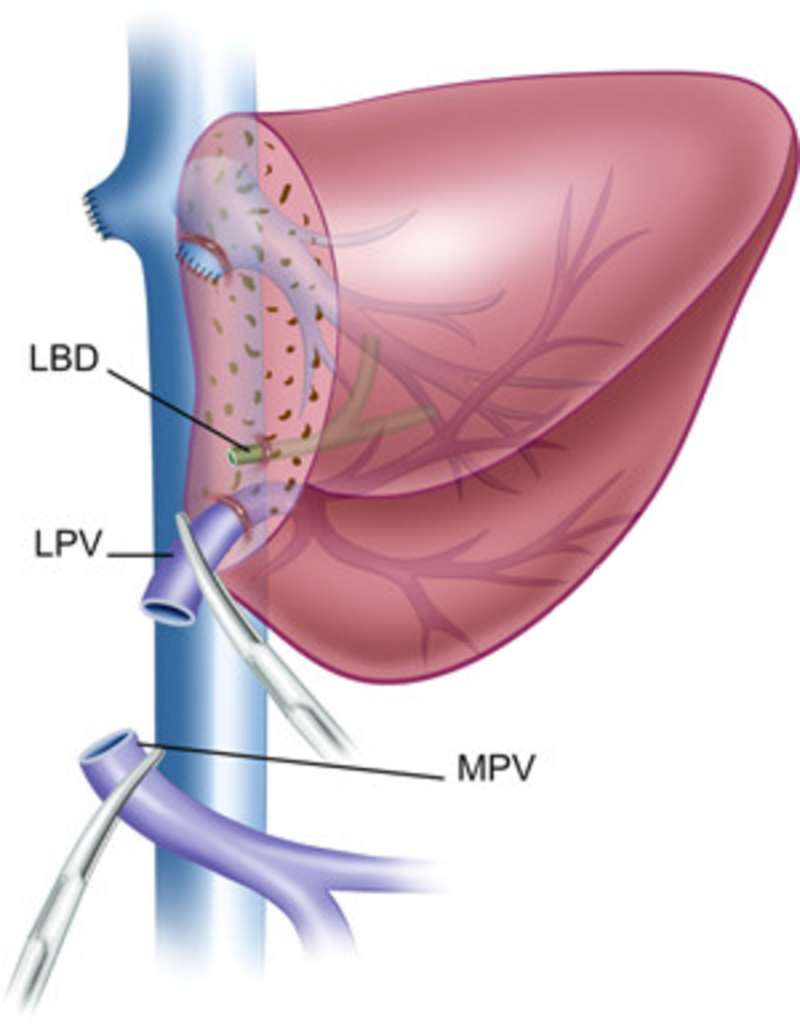
Левый латеральный сектор печени.
Реципиентский этап.
Операция у детей раннего возраста имеет ряд особенностей ввиду маленьких размеров брюшной полости ребёнка и проявлений основной болезни: гепатомегалии, спленомегалии, а также портальной гипертензии. Факторами, осложняющими операцию, могут быть последствия перенесённого ранее оперативного вмешательства. После пересечения связочного аппарата печени, мобилизации над-, подпечёночных и ретропечёночного отделов нижней полой вены и диссекции на протяжении элементов печёночно-двенадцатиперстной связки приступают к собственно гепатэктомии, которая включает:
- лигирование и пересечение долевых печёночных артерий;
- пережатие воротной вены сосудистым зажимом над областью слияния верхней брыжеечной и селезёночной вен;
- пережатие подпечёночного (над устьями почечных вен), затем надпечёночного отделов нижней полой вены;
- отсечение печени острым путём по паренхиме над нижней полой веной с оставлением на ней небольшого фрагмента;
- продольное рассечение остатка печени над нижней полой веной;
- прецизионное лигирование, клипирование и пересечение коротких вен, дренирующих преимущественно I сегмент и следующих к нижней полой вене от правой доли печени.
Методика имплантации левого латерального сектора печени После скелетизации и проверки герметичности нижней полой вены приступают к наложению сосудистых анастомозов. При наложении гепатико-кавального анастомоза необходимо создание широкого соустья путём объединения устий печёночных вен реципиента с последующим рассечением нижней полой вены в нисходящем направлении, таким образом создается треугольный дефект последней высотой 2,5-3 см, адекватный сформированному устью левой печ ночной вены трансплантата. Анастомоз накладывается непрерывным швом нитью PDS 5/0 или 4/0. Следующим накладывается порто-портальный анастомоз непрерывным швом нитью PDS 6/0. Завершение портальной реваскуляризации позволяет осуществить реперфузию трансплантата путём поочерёдного снятия зажимов:
- с надпечёночного отдела нижней полой вены;
- с воротной вены;
- с подпечёночного отдела нижней полой вены.
После выполнения гемостаза, следующего за реперфузией, в основном заключающегося в коррекции герметичности гепатикокавального анастомоза и дефектов стенки нижней полой вены, приступают к артериальной реконструкции. Принимается решение о выборе уровня печ ночной артерии реципиента для анастомозирования с левой долевой печёночной артерией трансплантата. Анастомоз накладывается атравматической нерассасывающейся нитью Prolene 7/0. Для увеличения просвета анастомозируемых сосудов прибегают к продольному рассечению соответствующих стенок артерий трансплантата и реципиента. Сосудистые анастомозы необходимо формировать при оптическом 3-х кратном увеличении операционного поля.
Билиарную реконструкцию выполняют путем наложения гепатикоеюноанастомоза с выключенной по Ру петлей тощей кишки. Диаметр протока трансплантата может быть увеличен за счет продольного рассечения его стенки. Дренирование желчных путей при выполнении билиарной реконструкции нецелесообразно. Операция завершается тщательным гемостазом и дренированием брюшной полости.
Послеоперационное ведение пациентов после трансплантации печени.
В раннем послеоперационном периоде пациентам проводится мониторинг, который включает в себя:
- ЭКГ – ежечасно, запись на ленту – 1 р/сут с последующим описанием в отделении функциональной диагностики;
- Пульсоксиметрия – постоянно;
- Частота дыхания – постоянно;
- Диурез – катетер Фолея со стерильным мочеприемником для измерения почасового диуреза;
- Контроль отделяемого из дренажей, учет отделяемого по каждому дренажу в отдельности;
- Учет отделяемого по назогастральному зонду;
- Температура тела – постоянно.
Помимо этого, оцениваются следующие данные:
- Контроль показателей газового и электролитного состава крови, кислотно- щелочного равновесия каждые 3 часа;
- Контроль показателей тканевого метаболизма каждые 3 часа: уровень лактата, содержание глюкозы в плазме крови;
- Общий анализ крови (подсчет форменных элементов крови, уровень гемоглобина, гематокрита) один раз в сутки в течение 1 дней, далее при благоприятном течении послеоперационного периода 2 раза в неделю;
- Биохимическое исследование крови (билирубин (общий прямой), АСТ, АЛТ, ЛДГ, ГГТ, ЩФ, мочевина, креатинин, холестерин) один раз в сутки в течение 7 дней, затем два раза в неделю;
- Показатели коагулограммы (время свертывания крови, протромбиновый индекс, МНО, агрегационная способность тромбоцитов, фибриноген, антитромбин III, протеин С) один раз в сутки в течение 7 дней, затем два раза в неделю;
- Контроль титров группоспецифических антител, проводится в течение первой недели после трансплантации – ежедневно, далее 1 раз в 1-2 дня.С 3-й недели после операции, при условии гладкого течения послеоперационного периода, определение титров антигрупповых антител проводится дважды в неделю. С 4-й недели после операции и до выписки пациентов, перенесших трансплантацию от АВО-несовместимого донора, из стационара достаточным можно считать определение группоспецифических антител 1 раз в неделю (при отсутствии эпизодов их повышения);
- Ежедневные микробиологические исследования крови в течение 7 суток, затем в течение 7 суток 2 раза в неделю;
- Определение концентрации иммуносупрессивных препаратов. В течение 14 суток – ежедневно, далее — не менее 2 раза в неделю;
- УЗИ — ежедневно 1-2р/сут в течение 14 суток;
- Рентгенография органов грудной клетки 1-2 раза в неделю первые 2-3 недели;
- КТ по показаниям
Пациентам проводится антибактериальная, противогрибковая, противовирусная, иммуносупрессивная, гастропротективная, спазмолитическая, инфузионно-трансфузионная терапия, которая подбирается индивидуально.
Иммуносупрессивная терапия, как правило, назначается пожизненно.
После выписки из стационара, пациент должен регулярно наблюдаться амбулаторно.
Болезнь Вильсона — Коновалова — симптомы и лечение
Что такое болезнь Вильсона — Коновалова? Причины возникновения, диагностику и методы лечения разберем в статье доктора Толмачева Алексея Юрьевича, невролога со стажем в 21 год.
Над статьей доктора Толмачева Алексея Юрьевича работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Болезнь Вильсона-Коновалова — редкое наследственное дистрофическое заболевание, которое развивается из-за избыточного накопления меди в организме. Больше всего металла скапливается в головном мозге, глазах (с образованием характерной пигментации), печени и почках. При этом в органах нарушается обмен веществ и прогрессируют дистрофические изменения [4] .
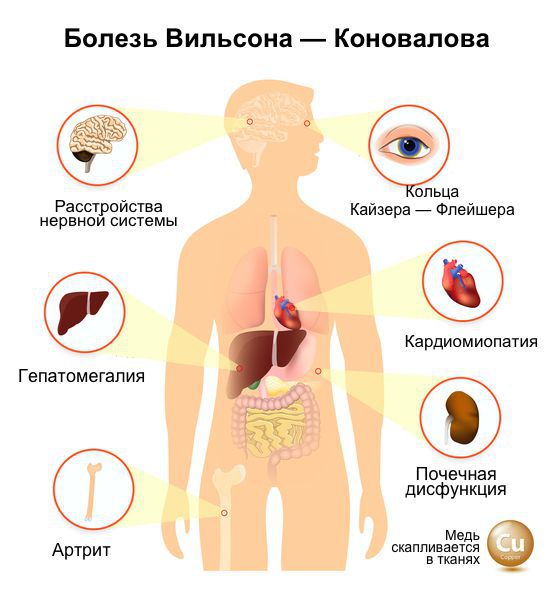
Заболевание впервые описано в 1912 году английским неврологом Семюэлем Вильсоном. В своём печатном труде он описал симптомы и особенности изменения внутренних органов при этом заболевании. Обычно первые проявления становились заметными в молодом возрасте, позже прогрессировала ригидность, сложности при глотании, снижение двигательной способности мягкого нёба, языка, губ (причина расстройства речи — дизартрии). Развиваются непроизвольные движения, расстройства психики — пониженное или необоснованно повышенное настроение, немотивированная агрессия, которая на поздних стадиях сменяется безучастностью, бредовые идеи, галлюцинации.
Российский невролог Николай Васильевич Коновалов изучал болезнь Вильсона на протяжении многих лет. Это позволило ему создать оригинальную полноценную классификацию различных форм заболевания. За огромный вклад Коновалова в исследование проблемы фамилия учёного навсегда дополнила название болезни.
Частота встречаемости — от 1 до 9 случаев на 100000 населения.
Основная причина возникновения болезни — мутация гена с названием ATP7B, который ответственен за встраивание ионов меди в белок церулоплазмин [14] . Всего описано более 300 мутаций этого гена. База данных мутаций постоянно расширяется новыми вариантами [6] . По международным оценкам, носителем аномального гена является примерно 1 человек из 100. При данном виде наследования заболевание проявляется симптоматикой только в том случае, если патологический ген был унаследован от обоих родителей. Мальчики и девочки болеют с одинаковой частотой [1] [2] [3] [8] [15] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы болезни Вильсона — Коновалова
Симптомы при заболевании подразделяют на четыре группы:
- проявления заболевания, связанные с поражением печени;
- неврологическая симптоматика;
- психическая симптоматика;
- изменения со стороны остальных внутренних органов.
Наиболее значимые проявления заболевания — поражения печени, неврологические и психические симптомы, изменения со стороны глаз.
Симптомы поражения внутренних органов при болезни Вильсона — Коновалова [3] :
Изменения со стороны печени выделяют среди первых симптомов заболевания (часто они проявляются в возрасте 4-5 лет). Иногда болезнь Вильсона — Коновалова проявляется острым или хроническим гепатитом, который можно принять за воспалительное бактериальное или вирусное поражение печени. Патологический процесс начинается с быстрого развития желтухи: кожные покровы и видимые слизистые, белок глаз приобретают жёлтый оттенок. К изменению цвета кожных покровов могут присоединиться симптомы интоксикации и астении (общей слабости, повышенной утомляемости, неустойчивости настроения). Также возможна анорексия — потеря аппетита и отказ отвращение к пище.
Неврологические симптоматика и проявления психических заболеваний при болезни Вильсона — Коновалова встречаются в 35 и 10 % случаев, обычно в возрасте с 10 до 35 лет, хотя встречаются и поздние случаи начала в 55 лет. Неврологические проявления включают нарушение координации с дрожанием конечностей при удержании позы, также возможен тремор в состоянии покоя. Развиваются синдром мышечной дистонии — непроизвольного сокращения мышц с изменением нормального положения тела. Изменения тонуса мышц приводит к нарушению ходьбы. Также из-за уже указанных нарушений работы мышц изменяется речь. Возникает повышенное слюноотделение.
Психиатрическая симптоматика примерно у трети пациентов предшествует всем остальным симптомам. Так как проявления неспецифичны, их обычно не связывают с болезнью Вильсона — Коновалова. У детей отмечается задержка или остановка умственного развития, снижение успеваемости в школе и способности концентрировать внимание. Наблюдается резкая смена настроения — неадекватное чувство счастья и восторга сменяется мимолетным чувством страха и необоснованной тревоги. Возможно вспышки агрессии или сексуальные отклонения. Острые психиатрические нарушения (психозы) случаются редко.
У взрослых пациентов снижается скорость мыслительных процессов при сохранной памяти на прошлые события. По мере развития слабоумия агрессию и депрессию сменяет беспричинная эйфория, а затем эмоциональная тупость и безучастность. Нарастают такие симптомы как беспричинный смех и плач, болезненные рефлексы ротовой мускулатуры, хватательные автоматизмы [10] .
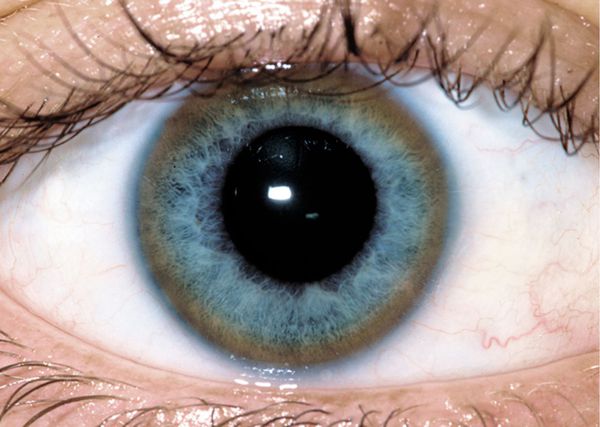
К поражениям глаз при болезни Вильсона относят кольца Кайзера-Флейшера и медную катаракту по типу «подсолнух». Но правильно трактовать эти симптомы может только специалист, так как они встречаются также при отравлении медью. Кольца Кайзера-Флейшера не всегда видны невооруженным глазом, иногда они обнаруживаются только при офтальмологическом осмотре при помощи щелевой лампы [1] [2] [3] [8] [15] .
Патогенез болезни Вильсона — Коновалова
Основной механизм развития болезни Вильсона — Коновалова — это нарушение обменных процессов в организме, в результате которых медь накапливается в различных органах и тканях с прогрессирующим нарушением их функций. Кроме того, за различные симптомы отвечает разнообразие мутаций гена ATP7B, определяющего, как именно проявится заболевание [12] .
Ген ATP7B кодирует белки, ускоряющие химические реакции меди у человека: АТФ-азу 7А и АТФ-азу 7В. Первый фермент способствуют всасыванию меди в кишечнике и её проникновению в головной мозг. Фермент мРНК АТФ-аза 7В обнаружен в клетках печени и сосудах капиллярах мозга. Он способствует выведению меди из головного мозга в кровь и из крови в желчь. Дефицит этого биологически активного вещества вызывает болезнь Вильсона — Коновалова.
Накопление меди в организме вызывает хроническое отравление (интоксикацию). Накапливаясь в печени и мозге, медь способствует гибели клеток этих органов. Это вызывает воспалительную реакцию и разрастание соединительной ткани в печени — фиброз печеночных протоков с нарушением их функций, из-за чего позже формируется цирроз. Гибель нервных клеток и их растворение (лизис) в головном мозге образует полости (кисты). Изменения других органов и тканей, как правило, незначительны.
При выбросе меди из разрушенных клеток в кровь под воздействием внешних факторов (инфекции, интоксикации, реакции на медикаменты) концентрация меди в плазме крови может повыситься в несколько раз. Это вызывает массированный распад эритроцитов, что приводит к тяжелому, чаще смертельному осложнению — фульминантной ( от лат. fulmino — молниеносный, мгновенно и быстро развивающийся) печеночной несостоятельности.
Всё многообразие симптомов болезни Вильсона — Коновалова вызывает не только накопление меди, но и отравление продуктами распада собственных клеток (аутоинтоксикация) [1] [2] [3] [7] [8] [15] .
Классификация и стадии развития болезни Вильсона — Коновалова
В России чаще всего применяется классификация, которая построена на клинических особенностях болезни, сочетания поражения печени и центральной нервной системы. Течение болезни Вилсона — Коновалова подразделяют на:
- бессимптомную форму;
- печеночную форму;
- церебральную форму;
- смешанную форму.
Также применяется классификация Коновалова, которая включает пять форм гепато-церебральной дистрофии:
- Брюшная (абдоминальная) форма — тяжёлое поражение печени, которое проявляется гепатопатией, вильсоновским гепатитом, циррозом печени и фульминарной печёночной несостоятельностью. Может привести к смерти до появления симптомов со стороны нервной системы. Продолжительность от нескольких месяцев до 3-5 лет;.
- Ригидно-аритмогиперкинетическая (ранняя) форма — характеризуется быстрым течением и начинается в детском возрасте. Среди симптомов преобладает мышечная скованность, приводящая к изменениям суставов и их тугоподвижности. Движения замедляются, руки и ноги могут непроизвольно двигаться спирально и червеобразно в сочетании с быстрыми непроизвольными сокращениями мышц. Характерны нарушения речи (дизартрия) и глотания (дисфагия), насильственный, непроизвольный смех и плач, нарушения эмоционального состояния, умеренное снижение интеллекта. Заболевание продолжается 2-3 года, заканчивается смертельным исходом.
- Дрожательно-ригидная форма встречается чаще остальных; начинается в юношеском возрасте, протекает медленно, иногда с периодами полного или неполного восстановления и внезапными ухудшениями, сопровождающиеся повышением температуры тела до 37–38 °C ; характерно одновременное развитие тяжёлой скованности мышц и ритмичного дрожания частотой 2-8 подёргиваний в секунду. Эти симптомы резко усиливаются при движениях и волнении, но исчезают в покое и во сне. Иногда наблюдаются дисфагия и дизартрия. Средняя продолжительность жизни около 6 лет.
- Дрожательная форма проявляется с возраста 20-30 лет, течёт относительно медленно (10-15 лет и более); преобладает дрожание, ригидность появляется лишь в конце болезни, иногда наблюдается пониженный тонус мышц; отмечается отсутствие мимики, медленная монотонная речь, тяжёлые изменения психики, частые эмоциональные вспышки, судорожные припадки.
- Экстрапирамидно-корковая форма встречается реже других. Типичные для гепато-церебральной дистрофии нарушения в дальнейшем осложняются внезапно развивающимися двигательными расстройствами по типу параличей (пирамидными парезами), судорожными (эпилептиформными) припадками и слабоумием тяжёлой степени. Длится 6-8 лет, заканчивается летально.
По течению заболевание можно разделить на две сменяющиеся стадии:
- латентная — характеризуется отсутствием внешних проявлений болезни, характерные изменения определяются только при лабораторном исследовании;
- стадия клинических проявлений — появляются специфические симптомы болезни гепато-церебеллярной дегенерации.
Во время лечения выделяют также стадию отрицательного баланса меди, при которой наблюдается регресс клинической симптоматики и характерных лабораторных изменений [4] .
Осложнения болезни Вильсона — Коновалова
Фульминантная форма гепатита (Вильсоновский криз) — одно из самых опасных осложнений (смертность около 60-95 %). Провоцирующим фактором становятся инфекции или интоксикации. Характерен массовый некроз клеток печени. В дальнейшем медь из поврежденных гепатоцитов обильно выделяется в кровь, что приводит к быстрому разрушению эритроцитов. Свободный гемоглобин из разрушенных эритроцитов дополнительно повреждают печень, замыкая патологический круг тяжелейшей интоксикации и оказывая токсическое действие на почки и другие органы. Характерный симптом — «тающая печень» (печень быстро уменьшается в размерах).
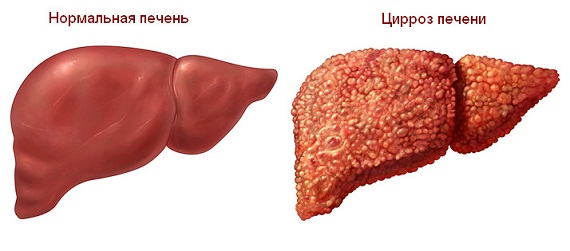
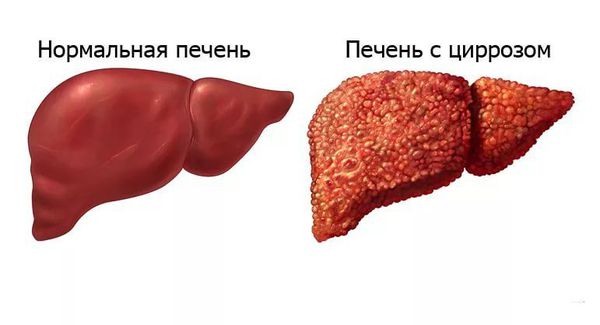
Цирроз — замещение нормальной ткани печени фиброзной (соединительной). Долгое время может прогрессировать без симптоматики, но при неврологических проявлениях болезни Вилсона — Коновалова присутствует у всех пациентов в той или иной степени. Цирроз печени приводит к постепенному нарушению её функций — особенно дезинтоксикации.
Гемолиз — повышенное разрушение красных телец крови (эритроцитов). Приводит к снижению количества эритроцитов и гемоглобина в крови — анемии. Основная функция эритроцитов — это доставка кислорода органам и тканям, поэтому снижение их количества приводит к недостаточному поступление кислорода. Это влечёт за собой нарушение метаболизма, внутренние органы начинают работать неправильно. Данное осложнение может протекать в острой, хронической и рекуррентной форме.
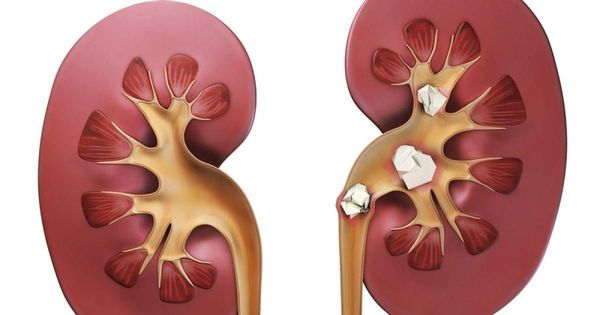
Образование камней в почках происходит из-за нарушения функционирования канальцев почек из-за накопления в почках меди. Камни мешают нормальной работе почек, ухудшают процесс фильтрации и усложняют процесс выделения мочи.
Параноидный бред — психотическое нарушение, чаще выражается в виде идей преследования, уничтожения, обвинения, ущерба или отравления [10] . Бред может быть как преходящим, так и затяжным. Возможно появление галлюцинаций.
Диагностика болезни Вильсона — Коновалова
Диагноз основывается на сочетании клинических симптомов, лабораторных данных и молекулярно-генетического тестирования. Ни один лабораторный тест, за исключением определения болезнетворного гена АТР7В на молекулярном уровне, не обеспечивает 100 % гарантию диагностики заболевания.
Основные диагностические показатели болезни Вильсона — Коновалова:
Суммарные баллы:
- 4 и более — высокая вероятность болезни;
- 2-3 — болезнь вероятна, но требуется дальнейшее обследование пациента;
- 0-1 — болезнь сомнительна.
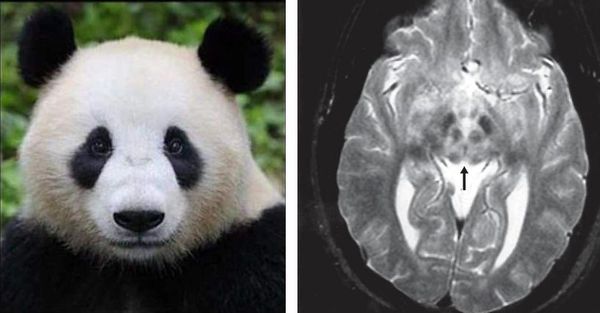
Для уточнения степени поражения и формы заболевания используются МРТ головного мозга, хотя только на основании МРТ диагноз поставить нельзя. При МРТ исследовании сразу видны характерные очаги и уменьшение объёма головного мозга. Специфичным, но более редко встречающимся симптомом при данном заболевании на МРТ снимке является картина, напоминающая «лицо гигантской панды». КТ- и МРТ-проявления могут опережать клиническую симптоматику.
Компьютерная томография (КТ) головного мозга при наличии болезни выявляет увеличение желудочков, атрофию коры и ствола мозга. Однако более важным диагностическим методом при церебральной форме заболевания является именно МРТ.
Для определения очагов скопления меди и нехирургической оценки метаболизма мозга может потребоваться магнитно-резонансная спектроскопия (МРС). Это метод, позволяющий оценить изменения биохимической концентрации веществ при различных заболеваниях в тканях организма.
Также используется позитронно-эмиссионная томография (ПЭТ), позволяющая определить степень обмена и транспорта веществ в организме.
Перспективным методом ранней диагностики является транскраниальное УЗИ головного мозга.
Изменения, определяемые при УЗИ, КТ и МРТ печени и почек определяются и при других болезненных состояниях, поэтому не являются строго специфичными для болезни Вильсона — Коновалова и могут быть использованы только для оценки эффективности лечения.
Новым методом диагностики степени выраженности цирроза (фиброза) печени является эластометрия печени. Исследование использует способность ультразвука проходить с различной скоростью через ткани разной плотности, что позволяет определить изменение нормальной плотности органа [1] [2] [3] [8] [16] .
Лечение болезни Вильсона — Коновалова
Целью лечения при бессимптомной стадии болезни является предотвращение проявления симптомов и нормализация лабораторных показателей. Цель на стадии клинических проявлений — стабилизация и максимально возможная регрессия основных симптомов заболевания, а также нормализация лабораторных показателей. Лечение болезни Вилсона — Коновалова можно разделить на несколько направлений.
Медикаментозное лечение. Включает в себя использование препаратов, выводящих медь из организма (медьэлиминирующая или хелатная терапия), а также использование препаратов, снижающих усвоение меди. Данное лечение назначается пожизненно.
Мировая практика предусматривает применение следующих комплексообразующих препаратов: пеницилламин, триентин, тетратиомолибдат и унитиол. Из таблетированных лекарственных средств в Российской Федерации зарегистрированы препараты d-пеницилламина.
Также при болезни Вилсона — Коновалова используются медикаменты, замедляющие и уменьшающих степень поражения органов мишеней при интоксикации медью (патогенетическая терапия). Кроме того, проводится симптоматическая терапия. Для лечения симптомов заболевания и восстановление поражённых органов используются витамины группы B, С и Е, нейропротективные и нейрометаболические средства, антиконвульсанты для лечения судорожного синдрома, препараты для коррекции психических симптомов заболевания.
Лечение препаратами, содержащими витамины группы В, способно улучшить функционирование нервной ткани, процессы её восстановления и обмен веществ. Наиболее известными комбинированными препаратами этой группы являются мильгамма и комбилипен. Витамин С (аскорбиновая кислота) способствует удалению меди из организма.
Витамин Е (альфа-токоферола-ацетат) является антиоксидантом, способным замедлять процессы окисления в организме и защищать клетки от повреждающего действия и разрушения [5] [7] .
При поражении печени оправдано применение L-орнитина-L-аспартата и других гепатопротекторов. При периферических отёках и осците назначают мочегонные. Также при выраженных отёках возможно использование фуросемида (лазикса). В случае тремора рук и насильственных движениях назначают лоразепам или клоназепам. В случае невротических проявлений (тревожности, депрессии) назначают различные антидепрессаны и анксиолитики [14] .
Диетотерапия. Полное удаление меди из рациона невозможно, так как она содержится во всех продуктах. Однако необходимо исключить из пищи продукты, в которых содержание меди превышает 0,5 мг/100 г: субпродукты, моллюски, орехи, какао-продукты, грибы, бобовые, гречневая и овсяная крупа. Следует сократить потребление сахара, рафинированных углеводов и трансжиров. В целом диету при данном заболевании можно охарактеризовать как молочно-растительную, с достаточным содержанием белка.
Хирургическое лечение. Трансплантация печени при заболевании проводится в следующих случаях:
- при развитии фульминантной (молниеносной) печеночной несостоятельности;
- при безрезультатном лечении препаратами, связывающими медь в течение 3 месяцев;
- пациентам с декомпенсированным циррозом печени – нарастающей симптоматики печёночной недостаточности.
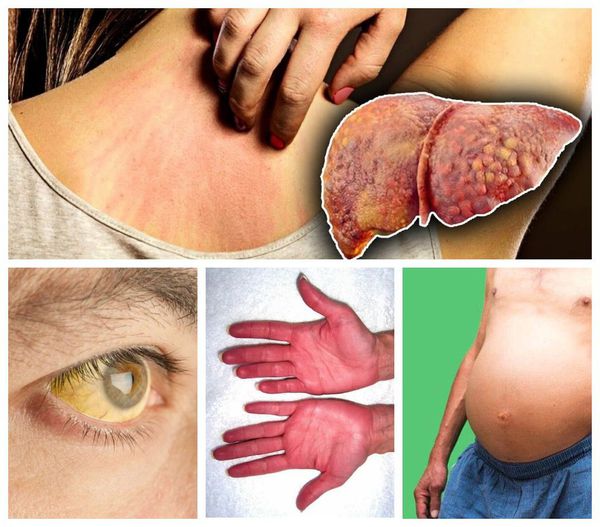
Декомпенированный цирроз печени — это нарушение нормальной работы печени, проявляющееся симптомами грубого нарушения пищеварительной функции. Проявляется следующим образом:
- Желтушность кожных покровов, склер глаз и слизистой рта;.
- Покраснение ладоней (печёночные ладони).
- Зуд кожи из-за накопления токсинов.
- Сосудистые звездочки, а также склонность к кровотечениям и гематомам при малейших повреждениях кожного покрова.
- Потеря аппетита, потеря веса вплоть до истощения;.
- Боли в области правого подреберья, иногда боли в животе без чёткой локализации.
- Накопление жидкости в брюшной полости (асцит).
- Печеночная энцефалопатия — прогрессирующее нарушение функций мозга (памяти, внимания мышления), изменение личности с неадекватным поведением различной выраженности, нарушение сознания (вплоть до комы). При несвоевременном лечении болезнь может привести к летальному исходу.
При трансплантации используется донорская пересадка печени — печень пересаживают целиком или частично. Трансплантация печени обеспечивает улучшение неврологической симптоматики более чем в 50 % случаев. При пересадке печени на стадии декомпенсированного цирроза печени выживание в течение первого года составляет 95 %, через 5 лет – 83 %, через 10 лет – 80%.
Плазмофильтрация и гемосорбция. Для удаления меди из организма также применяются фильтрация крови и плазмы: (плазмофильтрация и гемосорбция). При первой процедуре больного подключают к аппаратуре, благодаря которой кровь из одной руки, пройдя через аппарат, возвращается в другую. Клетки крови возвращаются в кровеносное русло сразу, а плазма проходит сквозь поры особого высокотехнологичного фильтра, где избавляется от продуктов распада и в очищенном виде возвращается в организм. При гемосорюбции цельная кровь пациента пропускается через ёмкость заполненную веществами – сорбентами.
В целом весь период лечения болезнь Вилсона — Коновалова можно разделить на 2 фазы: начальную фазу и фазу поддерживающей терапии. Критерием перехода на поддерживающую терапию является нормализация показателей обмена меди при 2-х последовательных исследованиях, выполненных с интервалом в 3 месяца [1] [2] [3] [8] [17] .
Прогноз. Профилактика
Болезнь Вильсона — Коновалова — это прогрессирующие заболевание, поэтому при отсутствии своевременного лечения больные умирают от цирроза печени или от инфекционно-токсических осложнений (редко). На фоне прогрессирующей неврологической симптоматики пациент может находиться в обездвиженном состоянии. При лечении выводящими медь препаратами и трансплантации печени длительная выживаемость пациентов является нормой.
Факторы, повышающие смертность при болезни Вильсона-Коновалова :
- Поздно установленнй диагноз.
- Самовольный отказ от лечения.
- Связанные с неврологической симптоматикой несчастные случаи.
- Невозможность подобрать эффективное лечение [5] .
Годовая выживаемость после трансплантации печени из-за фульминантной недостаточности достигает 70 %. Без трансплантации — единичные случаи. При декомпенсированном циррозе печени после трансплантации выживаемость пациентов в течение года — 95 %, через 5 лет — 83 %, через 10 лет — 80 %. Обратное развитие неврологической симптоматики после трансплантации отмечается более чем в 50 % случаев.
Восстановление функций печени происходит на 1-2 году лечения и не прогрессирует при полном выполнении всех рекомендаций. При фульминантном течении заболевания эффективно только оперативное лечение.
Специфической профилактики (вакцин, сывороток) для заболевания не существует в связи с его генетической природой.
Пациенты с болезнью Вильсона — Коновалова, которые узнают о диагнозе в результате плановых обследований и не имеют заметных симптомов, не воспринимают медикаментозное лечение как обязательное. В таком случае стоит говорить не о истинной профилактике заболевания, а скорее о профилактике внешних проявлений (клиники) болезни Вильсона — Коновалова и просветительской работе [9] .
Профилактика заболевания включает:
- медико-генетическое консультирование;
- пренатальную (предродовую) диагностику;
- преимплантационную генетическую диагностику.
Скрининг у пациентов, имеющих необъяснимое повышение сывороточных аминотрансфераз, хронический гепатит, цирроз печени и неврологические нарушения неизвестного происхождения должен проводиться в возрасте от 2 до 18 лет. Все родственники по прямой линии больного с диагностированной болезнью должны проходить плановое обследование на наличие у них заболевания.
При беременности, когда имеется риск рождения пациента с болезнью Вильсона — Коновалова, проводится молекулярно-генетический анализ фетальных клеток на 15-18 неделе беременности или ворсинок хориона на 10-12 неделе.
Преимплантационная генетическая диагностика болезни Вильсона — Коновалова заключается в проведении ЭКО, возможности диагностики заболеваний до самого оплодотворения и последующей имплантации оплодотворенного эмбриона в организм женщины. Это может предотвратить зачатие ребенка с генетическими болезнями. Такой метод профилактики может быть выбором в ситуации, когда в семье уже определены мутантные гены, способные вызвать болезнь [1] [2] [3] [15] [17] .
Источник https://clinic-a-plus.ru/articles/gastroenterologiya/21502-bolezn-vilsona-konovalova.html
Источник https://doctorsemash.com/liver-transplantation/
Источник https://probolezny.ru/bolezn-vilsona-konovalova/